Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bài 3
Cu +2 AgNO3 -> Cu(NO3)2 + 2Ag
x...............2x.................................2x (mol)
theo bài ta có : 216x-64x=152x=2,28
==> x=0,015 (mol)=> n AgNO3=2x=0,03
==> CMAgNO3 =\(\dfrac{0,03}{\dfrac{30}{1000}}=1\left(M\right)\)
vậy............
bài 1
Zn + CuSO4 -> ZnSO4 + Cu
x x x (mol)
theo bài có 161x-160x=0,2==> x=0,2 = nZn
==> mZn tham gia = 0,2.65=13 (g)
vậy.........

\(Fe+CuSO_4\to FeSO_4+Cu\)
Đặt \(n_{CuSO_4}=x(mol)\)
\(\Rightarrow 64x-56x=2\\ \Rightarrow x=0,25(mol)\\ \Rightarrow n_{Fe}=n_{Cu}=0,25(mol)\\ \Rightarrow m_{Fe}=0,25.56=14(g);m_{Cu}=0,25.64=16(g)\)

2. Cho 1,96g bột sắt vào 100ml dd CuSO4 10% có khối lượng riêng là 1,12g/ml
a)Viết ptpư
b) Xác định nồng độ mol/lit của các chất trong dd sau khi pư kết thúc
c) Cô cạn dd thu được bao nhiêu gam muối khan
---------
nFe= 1,96/56= 0,035(mol)
mddCuSO4= 100.1,12= 112(g)
=> mCuSO4= (112.10)/100= 11,2(g)
=> nCuSO4= 11,2/160= 0,07(mol)
PTHH: Fe + CuSO4 -> FeSO4 + Cu
Ta có: 0,035/1 < 0,07/1
=> Fe hết, CuSO4 dư, tính theo nFe
=> dd sau phản ứng gồm dd FeSO4 và dd CuSO4 dư.
Ta có: nCuSO4(p.ứ)= nFeSO4= nFe= 0,035(mol)
=> nCuSO4(dư)= 0,07 - 0,035= 0,035(mol)
Vddsau= VddCuSO4= 100(ml)= 0,1(l)
=> \(C_{MddCuSO_4\left(dư\right)}=\dfrac{0,035}{0,1}=0,35\left(M\right)\)
\(C_{MddFeSO_4}=\dfrac{0,035}{0,1}=0,35\left(M\right)\)
- Cô cạn dd dc 2 loại muối khan: CuSO4 (dư) và FeSO4.
m(muối_khan)= mCuSO4+ mFeSO4= 0,035.160 + 0,035.152= 10,92(g)
1/
Cu+ 2AgNO3 -----> Cu(NO3)2+ 2Ag
Khối lượng dd giảm: mdd↓=340*6%*25%=5.1
Ta luôn có mdd giảm=mKL tăng=5.1g
Khối lượng vật sau p/ư: mvật=15+5.1=20.1 g

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
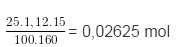
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:


Gọi số mol Zn bị hòa tan là a (mol)
PTHH: Zn + FeSO4 --> ZnSO4 + Fe
______a---------------------------->a
=> 50 - 65a + 56a = 49,82
=> a = 0,02 (Mol)
=> mZn = 0,02.65 = 1,3(g)

hỏi từng câu nhé bạn nhìn ngán lắm
ok bn