Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{KMnO_4} = 0,02452.0,001 = 2,452.10^{-5}(mol)\)
\(5CaC_2O_4 + 2KMnO_4 + 8H_2SO_4 \to 5CaSO_4 + K_2SO_4 + 2MnSO_4 + 8H_2O + 10CO_2\)\(Ca^{2+} + C_2O_4^{2-} \to CaC_2O_4\)
Theo PTHH:
\(n_{Ca^{2+}} = n_{CaC_2O_4} = \dfrac{5}{2}n_{KMnO_4} = 6,13.10^{-5}(mol)\)
Vậy thành phần canxi trong 1ml máu là : \(\dfrac{6,13.10^{-5}.40}{1,06}.100\% = 0,2313\%\)

Không viết phương trình nhá !!
a) Gọi a và b lần lượt là số mol của Mg và Al
\(\Rightarrow24a+27b=1,035\) (1)
Ta có: \(n_{H_2}=\dfrac{1,176}{22,4}=0,0525\left(mol\right)\)
Bảo toàn electron: \(2a+3b=2\cdot0,0525\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,015\\b=0,025\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,015\cdot24}{1,035}\cdot100\%\approx34,78\%\\\%m_{Al}=65,22\%\end{matrix}\right.\)
b) Ta có: \(\left\{{}\begin{matrix}\Sigma n_{H_2SO_4}=\dfrac{100\cdot9,8\%}{98}=0,1\left(mol\right)\\n_{H_2SO_4\left(p/ứ\right)}=n_{H_2}=0,0525\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,0475\left(mol\right)\) \(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,0475\cdot98=4,655\left(g\right)\)
c) Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,0125\left(mol\right)\\n_{MgO}=n_{Mg}=0,015\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{oxit}=0,0125\cdot102+0,015\cdot40=1,875\left(g\right)\)
a) Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(m_A=1,035\left(g\right)\rightarrow24a+27b=1,035\) (1)
\(Mg+2H_2SO_4đ\rightarrow MgSO_4+SO_2+2H_2O\)
a ------------ 2a ----------------------- a (mol)
\(2Al+6H_2SO_4đ\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
b ------------ 3b -------------------------- 1,5b (mol)
\(n_{SO_2}=\dfrac{1,176}{22,4}=0,0525\left(mol\right)\rightarrow a+1,5b=0,0525\) (2)
Giải hệ (1)(2) \(\rightarrow\left\{{}\begin{matrix}a=0,015\\b=0,025\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Mg}=0,015.24=0,36\left(g\right)\\m_{Al}=0,025.27=0,675\left(g\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Mg}=34,78\%\\\%m_{Al}=65,22\%\end{matrix}\right.\)
b) \(\Sigma_{n_{H_2SO_4}}=2a+3b=0,105\left(mol\right)\)
\(\rightarrow m_{H_2SO_4}=0,105.98=10,29\left(g\right)\)
c. \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,015\left(mol\right)\\n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=0,0125\left(mol\right)\end{matrix}\right.\)
\(\rightarrow m_{oxit}=0,015.40+0,0125.102=1,875\left(g\right)\)

H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé

1/ Gọi x, y lần lượt là số mol của Na2CO3 và KHCO3.
Khi cho từ từ HCl vào dung dịch A thì các phản ứng xảy ra lần lượt là :
CO3^2- + H^+ => HCO3-
x ---------> x ----------> x
HCO3^- + H+ => H2O + CO2.
0,045 <--- 0,045 <-------- 0,045
.........HCO3^- + OH- => CO3^2- + H2O.
x+y - 0,045 -------------> x+y-0,045.
Giải hệ: x+y-0,045 = 29,55/197; n HCl = x+ 0,045 = 0,15.
=> x = 0,105 ; y = 0,09.
2/ Nồng độ của HCO3- , CO3^2- lần lượt là 0,225 M; 0,2625 M.
3/ Cho từ từ dung dịch A vào bình đựng 100 ml dung dịch HCl 1,5 M => Các phản ứng xảy ra đồng thời:
CO3^2- + 2 H^+ => H2O + CO2.
HCO3- + H+ => H2O + CO2.
Do tỉ lệ trong hỗn hợp : n CO3^2-/ n HCO3- = 7/6 => 7x*2+6x = 0,15 => x=0,0075.
=> V = 2,184 lít.

\(Fe^{2+} \to Fe^{3+} + 1e\\ Mn^{+7} + 5e \to Mn^{2+}\\ \Rightarrow n_{Fe^{2+}} = 5n_{KMnO_4} = 0,18.5 =0,9(mol)\\ 2FeCl_3 + Fe \to 3FeCl_2\\ n_{FeCl_3} = \dfrac{2}{3}n_{FeCl_2} = 0,6(mol)\\ n_{Fe\ pư} = \dfrac{1}{3}n_{Fe} = 0,3(mol)\\ \Rightarrow m_{Fe\ trong\ A} = 2,8 + 0,3.56 = 19,6(gam)\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Fe} = n_{FeCl_3} = 0,6(mol)\\\)
Phần trăm khối lượng Fe tham gia phản ứng là : \(\dfrac{0,6.56}{0,6.56 + 19,6}.100\% = 63,15\%\)
a ơi nhưng trong đề của cô e cho 4 đáp án không có đáp án 63,15%

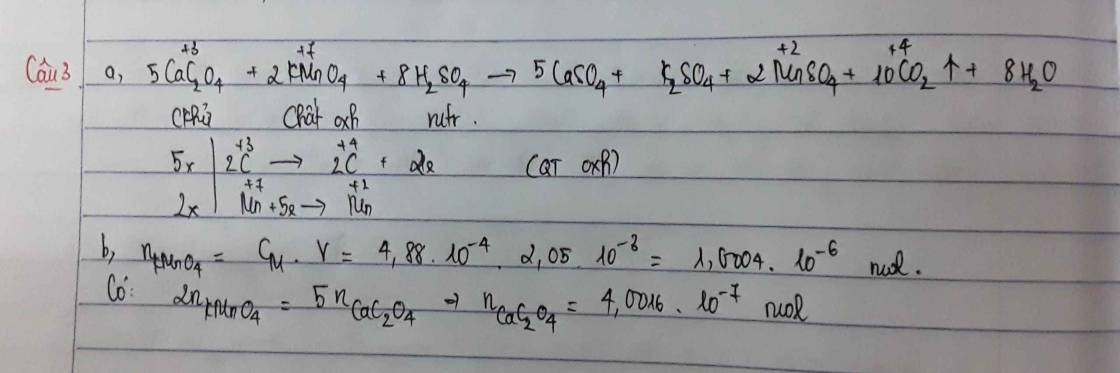
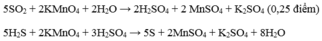

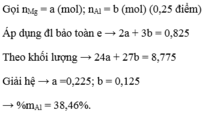
Ta có: nKMnO4 = 1,055.10-3 (mol)
BT e, có: 6nH2C2O4 = 5nKMnO4
⇒ nH2C2O4 = 8,792.10-4 (mol) = nCaC2O4 = nCa2+
\(\Rightarrow\%m_{Ca}=\dfrac{8,792.10^{-4}.40}{2}.100\%\approx1,7583\%\)