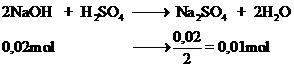Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cu}=0,2\left(mol\right)\)
\(Cu+2H_2SO_4\left(đ,đ\right)\underrightarrow{t^0}CuSO_4+SO2+2H_2O\)
\(0,2\) \(0,2\)
\(m_{CuSo_4}=32\left(g\right)\)
Mà thực tế : \(m_{CuSO_4}=28\left(g\right)\)
\(\Rightarrow H=87,5\%\)

nồng dộ của dung dịch H2SO4 và NaOH là a và b,ta có
H2SO4 + 2NaOH = Nà2SO4 + 2H2O
0,02a--------0,04a
=>0,04a=0,06b
H2SO4+2NaOH=Na2SO4+2H2O
0,01b/2---0,01b
H2SO4+BaCO3=BaSO4+H2O+CO2
0,03--------0,03
=>0,02a-0,01b/2=5,91/197=0,03
=>a=1,8 và b=1,2

đúng là có làm mới cos ăn nhưng câu này mk vẫn chx hiểu đc á bạn

1/
a)
\(n_{Ba}=\frac{27,4}{137}=0,2mol\); \(n_{H_2SO_4}=\frac{9,8}{98}=0,1mol\)
PTHH: \(Ba+H_2SO_4\rightarrow BaSO_4\downarrow+H_2\uparrow\)
Trước pư: \(0,2\) \(0,1\) \(\left(mol\right)\)
Pư: \(0,1\) \(0,1\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Sau pư: \(0,1\) \(0\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Sau pư còn dư 0,1mol Ba nên Ba tiếp tục pư với H2O trong dd:
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)
\(0,1\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Tổng số mol H2 sau 2 pư : \(n_{H_2}=0,1+0,1=0,2mol\)
Thể tích khí thu được: \(V_{H_2}=0,2.22,4=4,48l\)
b)
Dd thu được sau pư là dd \(Ba\left(OH\right)_2\)
\(m_{Ba\left(OH\right)_2}=0,1.171=17,1g\)
\(m_{dd}=27,4+100-m_{BaSO_4}-m_{H_2}\)\(=27,4+100-0,1.233-0,2.2=103,7g\)
\(C\%_{ddBa\left(OH\right)_2}=\frac{17,1}{103,7}.100\%\approx16,49\%\)
2/
\(n_{H_2S}=\frac{0,672}{22,4}=0,03mol\)
\(CaS+2HBr\rightarrow CaBr_2+H_2S\uparrow\)
Theo pt:
\(n_{CaS}=n_{CaBr_2}=n_{H_2S}=0,03mol\) ; \(n_{HBr}=0,06mol;\)\(m_{HBr}=0,06.81=4,86g\)
\(m=m_{CaS}=0,03.72=2,16g;\)\(m_{CaBr_2}=0,03.200=6g\)
\(\Rightarrow m_1=\frac{4,86.100}{9,72}=50g\)
Áp dụng ĐLBTKL:
\(m_2=m_{ddCaBr_2}=50+2,16-34.0,03=51,14g\)
\(x=C\%_{CaBr_2}=\frac{6.100}{51,14}\approx11,73\%\)

Fe + H2SO4 \(\rightarrow\)FeSO4 + H2 (1)
2Al + 6H2SO4 \(\rightarrow\)Al2(SO4)3 + 3H2 (2)
mH2 bay ra sau PƯ=16,6-15,6=1(g)
nH2=\(\dfrac{1}{2}=0,5\left(mol\right)\)
Đặt nFe=a
nAl=b
Ta có:
\(\left\{{}\begin{matrix}56a+27b=16,6\\a+\dfrac{3}{2}=0,5\end{matrix}\right.\)
=>a=b=0,2
mFe=56.0,2=11,2(g)
%mFe=\(\dfrac{11,2}{16,6}.100\%=67,47\%\)
%mAl=100-67,47=32,53%
b;
Theo PTHH 1 và 2 ta có:
nFe=nFeSO4=0,2(mol)
\(\dfrac{1}{2}\)nAl=nAl2(SO4)3=0,1(mol)
mmuối khan=152.0,2+342.0,1=64,6(g)

2NaOH +H2SO4----> Na2SO4 +2 H2O
TH1: NaOH dư
Theo pthh
n\(_{Na2SO4}=n_{H2SO4}=b\left(mol\right)\)
m=m\(_{Na2SO4}=142b\left(g\right)\)
TH2: H2SO4 dư
Theo pthh
n\(_{Na2SO4}=\frac{1}{2}n_{NaOH}=0,5a\left(mol\right)\)
m=m\(_{Na2SO4}=142.0,5a=71a\left(g\right)\)
Chúc bạn học tốt

PTHH: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(n_{H_2SO_4}=0,1\cdot0,5=0,05\left(mol\right)\) \(\Rightarrow n_{H_2O}=0,05mol\)
\(\Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4}=0,05\cdot98=4,9\left(g\right)\\m_{H_2O}=0,05\cdot18=0,9\left(g\right)\end{matrix}\right.\)
Áp dụng Định luật bảo toàn khối lượng, ta có:
\(m_{hh}+m_{ddH_2SO_4}=m_{muối}+m_{H_2O}\)
\(\Rightarrow m_{muối}=m_{hh}+m_{ddH_2SO_4}-m_{H_2O}=2,81+4,9-0,9=6,81\left(g\right)\)
Số mol
Phương trình