Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1> Mg+2HCl------>MgCl2+H2
Zn+2HCl----->ZnCl2+H2
mHCl=250.7,3/100=18,25 g
nHCl=18,25/36,50,5 mol
Giả sử 4,93 g hỗn hợp toàn là kim loại Mg
n tối đa =4,93/24=0,205 mol--->nHCl tối đa=0,205.2=0,41 mol
giả sử 4,93 g hỗn hợp toàn là Zn
n tối thiểu =4,93/65=0,076 mol----->nHCl tối thiểu=0,076.2=0,152 mol-
----->0,152<nHCltham gia phản ứng<0,41
mà nHcl=0,5 mol----->HCl dư-----> hỗn hợp tan hết

\(n_{HCl}=0,5\left(mol\right)\)
\(Al_2O_3+6HCl-->2AlCl_3+3H_2O\)
x................6x.......................2x...........3x
\(MgO+2HCl-->MgCl_2+H_2O\)
y..............2y........................y............y
\(\left\{{}\begin{matrix}6x+2y=0,5\\102x+40y=9,1\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
\(m_{Al_2O_3}=102.0,05=5,1\left(g\right)\)
\(m_{MgO}=9,1-5,1=4\left(g\right)\)
\(\%Al_2O_3=\dfrac{5,1}{9,1}.100\%\approx56,04\%\)
\(\%MgO=100\%-56,04\%=43,96\%\)

Cu không tác dụng với dung dịch HCl nên 12,8 gam là khối lượng của Cu.
n HCl = 91,25x20/(100x36,5) = 0,5 mol
Phương trình hóa học:
Mg + 2HCl → Mg Cl 2 + H 2
Fe + 2HCl → Fe Cl 2 + H 2
n Mg = x
n Fe = y
Ta có các phương trình:
24x + 56y = 23,6 - 12,8 = 10,8 (I)
2x + 2y = 0,5 (II)
Giải phương trình (I), (II) ta tìm được x và y:
x = 0,1; y = 0,15; m Mg = 2,4g; m Fe = 8,4g

\(a,n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{Fe}=n_{H_2}=0,15(mol)\\ \Rightarrow m_{Fe}=0,15.56=8,4(g)\\ \Rightarrow \%_{Fe}=\dfrac{8,4}{15}.100\%=56\%\\ \Rightarrow \%_{Cu}=100\%-56\%=44\%\\ b,n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,3}{0,1}=3M\)

Hướng dẫn cách làm ngắn gọn nha ! < 3
\(Theo-\text{đ}\text{ề}-b\text{ài}-ta-c\text{ó}:nH2=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Gọi x ,y lần lượt là số mol của Al và Ag
Ta có PTHH :
\(\left(1\right)2Al+3H2SO4->Al2\left(SO4\right)3+3H2\uparrow\)
x mol.........3x mol............. x mol..............3 xmol
\(\left(2\right)2Ag+H2SO4->Ag2SO4+H2\uparrow\)
y mol ........... y mol.............. y mol ....... ymol
Ta có PT : \(\left\{{}\begin{matrix}27x+108y=12\\3x+y=0,6\end{matrix}\right.\) => \(\left\{{}\begin{matrix}x=?\\y=?\end{matrix}\right.\)
a) Tìm được x và y rồi thì => ra được nAl và nAg = > %mAl và %mAg
b) Tìm được x ,y => nH2SO4 = 3x + y = ? => mH2SO4 = ? => mddH2SO4 = ?
Và sẽ => được VddH2SO4 = \(\dfrac{m\text{dd}H2SO4}{D}=?\)
Vậy.............

$n_{H_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
$n_{HCl} = 0,2(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$Na_2O + H_2O \to 2NaOH$
$NaOH + HCl \to NaCl + H_2O$
Theo PTHH :
$n_{Na} = 2n_{H_2} = 0,16(mol)$
$2n_{Na_2O} + n_{Na} = n_{NaOH} = n_{HCl} = 0,2$
$\Rightarrow n_{Na_2O} = 0,02(mol)$
$\%m_{Na} = \dfrac{0,16.23}{5}.100\% = 73,6\%$
$\%m_{Na_2O} = \dfrac{0,02.62}{5}.100\% = 24,8\%$

Khối lượng rắn không tan là khối lượng của Cu
=> \(n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
Gọi số mol Zn, Fe là a, b
=> 65a + 56b = 27,7 - 12,8 = 14,9
\(n_{HCl}=\dfrac{91,25.20}{100.36,5}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 +H2
_____a----->2a
Fe + 2HCl --> FeCl2 + H2
b---->2b
=> 2a + 2b = 0,5
=> a = 0,1; b = 0,15
\(\left\{{}\begin{matrix}\%Zn=\dfrac{65.0,1}{27,7}.100\%=23,466\%\\\%Fe=\dfrac{56.0,15}{27,7}.100\%=30,325\%\\\%Cu=\dfrac{12,8}{27,7}.100\%=46,209\end{matrix}\right.\)
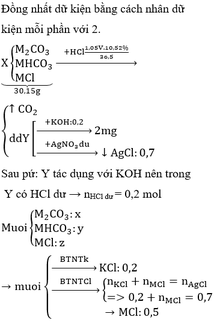
Bài 1 :
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
a 2a
\(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
b 2b
Gọi a là số mol của Mg
b là số mol của Zn
\(m_{Mg}+m_{Zn}=8,9\left(g\right)\)
⇒ \(n_{Mg}.M_{Mg}+n_{Zn}.M_{Zn}=8,9g\)
⇒ 24a + 65b = 8,9g (1)
Ta có : 100ml = 0,1l
\(n_{HCl}=4.0,1=0,4\left(mol\right)\)
⇒ 2a + 2b = 0,4(2)
Từ (1),(2), ta có hệ phương trình :
24a + 65b = 8,9
2a + 2b = 0,4
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(m_{Mg}=0,1.24=2,4\left(g\right)\)
\(m_{Zn}=0,1.65=6,5\left(g\right)\)
Chúc bạn học tốt
Bài 2:
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a________a (mol)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b_____3b________b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27b=8,3\\2a+3b=0,1\cdot5=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,1\cdot127=12,7\left(g\right)\\m_{AlCl_3}=0,1\cdot133,5=13,35\left(g\right)\end{matrix}\right.\)