Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Do Fe dư nên chỉ tạo ra Fe2+.
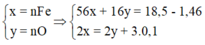
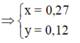
4H+ + NO3- + 3e → NO + 2H2O
2H+ + O + 2e → H2O
=> nHNO3 = nH+ = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64
=> [HNO3] = 0,64/0,2 = 3,2M => Chọn A.

Đáp án B
0,03 mol Ag + V ml AgNO3 0,7M → NO↑
CM AgNO3 = CM HNO3 dư
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
nHNO3phản ứng = 0,03 : 3 × 4 = 0,04 mol.
Vì V không thay đổi nên nHNO3 dư = nAgNO3 = 0,03 mol
→ ∑nHNO3 = 0,04 + 0,03 = 0,07 mol
→ VHNO3 = 0,07 : 0,7 = 0,1 lít = 100 ml

+ Tính được những gì có thể tính được
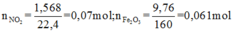
+ Với bài toán gồm nhiều giai đoạn liên tiếp nhau như thế này ta nên tóm tắt lại bài toán:
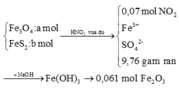
Bây giờ ta phải thiết lập được mối quan hệ giữa a và b với hi vọng là tìm được a và b rồi sau đó áp dụng các định luật bảo toàn như khối lượng, nguyên tố, electron ....
+ Bảo toàn nguyên tố Fe: 3a + b = nFe = 2.0,061 = 0,122
+ Bảo toàn sốmol electron trao đổi: a + 15b = 0,07.1 ( Chú ý FeS2→Fe3+ + 2S+6 + 15e)
Giải được a = 0,04; b = 0,002.
+ Tiếp tục sử dụng bảo toàn nguyên tố S:
![]()
+ Vì phản ứng xảy ra hoàn toàn và vừa đủ nên sau khi phản ứng với dung dịch NaOH ta chỉ thu được 2 muối là Na2SO4 và NaNO3.
Áp dụng định luật bảo toàn nguyên tố Na:
![]()
+ Cuối cùng dựa vào sơ đồ tóm tắt, ta sẽ dùng bảo toàn nguyên tố N
![]()
=>![]()
Đáp án D

Tuy nhiên, trong các lựa chọn đề bài không có 0.376 N. Có thể cần kiểm tra lại các bước hoặc điều kiện của bài toán. Bạn có thể kiểm tra lại xem có sai sót nào không hoặc cần thêm thông tin gì không?
- Nồng độ đương lượng của dung dịch HCl trong dung dịch A là: 0.376 N.

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư Û 0,12 = 0,39V + 0,01V + 0,0036.
⇔ V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam