Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol
C
O
2
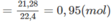
Khối lượng C trong A là: 0,95.12 = 11,4 (g).
Số mol
H
2
O
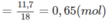
Khối lượng H trong A là: 0,65.2 = 1,3 (g).
Tổng khối lượng của C và H chính là tổng khối lượng 2 hiđrocacbon. Vậy, khối lượng N2 trong hỗn hợp A là : 18,30 - (11,4 + 1,3) = 5,6 (g)
Số mol
N
2
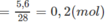
Số mol 2 hidrocacbon 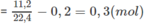
Đặt lượng C x H y là a mol, lượng C x + 1 H y + 2 là b mol :
a + b = 0,2 (1)
Số mol C = số mol C O 2 , do đó :
xa + (x + 1)b = 0,95 (2)
Số mol H = 2.số mol H 2 O , do đó :
ya + (y + 2)b = 2. 0,65= 1,3
Từ (2) ta có x(a + b) + b = 0,95 ⇒ b = 0,95 - 0,3x
Vì 0 < b < 0,3, nên 0 < 0,95 - 0,3x < 0,3
Từ đó tìm được 2,16 < x < 3,16 ⇒ x = 3.
⇒ b = 0,95 − 3.0,3 = 5. 10 - 2
⇒ a = 0,3 − 0,05 = 0,25
Thay giá trị tìm được của a và b vào (3), ta có y = 4.
% về khối lượng của C 3 H 4 trong hỗn hợp A:

% về khối lượng của C 4 H 6 trong hỗn hợp A :


Số mol 2 chất trong 6,55 g M là: 
Số mol 2 chất trong 2,62 g M là: 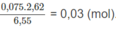
Giả sử trong 2,62 g M có a mol C x H y và b mol C x + 1 H y + 2
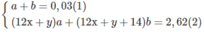
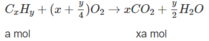
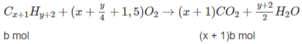
xa + (x + 1)b = 0,2 (3)
Từ (3), ta có x(a + b) + b = 0,2
b = 0,2 - 0,03x
Vì 0 < b < 0,03 nên 0 < 0,2 - 0,03x < 0,03.
⇒ 5,67 < x < 6,67 ⇒ x = 6 .
b = 0,2 - 0,03.6 = 0,02; a = 0,03 - 0,02 = 0,01
Thay giá trị của a và b vào (2), tìm được y = 6.
Khối lương
C
6
H
6
chiếm 
Khối lương C 7 H 8 chiếm 100 - 29,8% = 70,2%.

Đặt lượng C x H y là a mol, lượng C x + 1 H y + 2 là b mol.
Ta có : a + b = 0,05 (1)
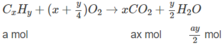
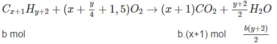
Số mol C O 2 : ax + b(x + 1) = 0,170 (2)
Số mol
H
2
O
: 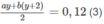
Từ (2) ta có (a + b)x + b = 0,170 ;
b = 0,170 - 0,0500x
b là số mol của một trong hai chất nên 0 < b < 0,0500.
Do đó 0 < 0,170 - 0,0500x < 0,0500 ⇒ 2,40 < x < 3,40 ⇒ x
= 3.
⇒ b = 0,1700 - 0,0500.3 = 0,0200 ⇒ a = 0,0500 - 0,0200 =


Đáp án C
Hướng dẫn
nCO2 = 1,3 mol; nH2O = 1,3 mol => Hidrocacbon là anken; CTPT là: C n - H 2 n -
CnH2n + 3n/2O2 → nCO2 + nH2O
nX = 0,5 mol => n - = 1,3/0,5 = 2,6 => 2 anken là: C2H4, C3H6
nC2H4 : nC3H6 = 2:3 => nC2H4 = 0,2 mol và nC3H6 = 0,3 mol
=>mC2H4 = 0,2.28 = 5,6 gam và mC3H6 = 0,3.42 = 12,6 gam

Đáp án B
Đốt cháy 0,09 mol hỗn hợp M bằng O2 vừa đủ thu được 0,459 mol hỗn hợp khí và hơi.
Dẫn N qua bình đựng H2SO4 dư thì H2O bị giữ lại → n H 2 O = 0 , 2295 m o l
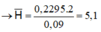
Do anken có số C lớn hơn 3 nên từ 6H trở lên vậy 2 amin có ít nhất 1 amin số H từ 5 trở xuống vậy có một amin có 5H amin còn lại có 7H.
Ta có:
![]()
![]()
![]()
Do vậy 2 amin phải là CH2=CHNH2 và C3H5NH2.
→ M X + M Y = 100

Đáp án B
Đốt cháy 0,09 mol hỗn hợp M bằng O2 vừa đủ thu được 0,459 mol hỗn hợp khí và hơi.
Dẫn N qua bình đựng H2SO4 dư thì H2O bị giữ lại
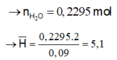
Do anken có số C lớn hơn 3 nên từ 6H trở lên vậy 2 amin có ít nhất 1 amin số H từ 5 trở xuống vậy có một amin có 5H amin còn lại có 7H.
Ta có:
![]()
![]()
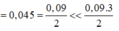
Do vậy 2 amin phải là CH2=CHNH2 và C3H5NH2.
→ M Y + M Z = 100

Khối lượng trung bình của 1 mol A :
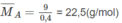
Trong hỗn hợp A phải có chất có M < 22,5 ; chất đó chỉ có thể là C H 4 .
Sau đó giải hệ 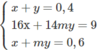
Ta tìm được m = 3; x = 0,3; y = 0,1.

Vì A và B là hiđrocacbon nên khi đốt cháy chỉ thu được CO2 và H2O.
Ta có: \(n_{O_2}=\dfrac{64}{32}=2\left(mol\right)\)
\(n_{CO_2}=n_{CaCO_3}=\dfrac{100}{100}=1\left(mol\right)\)
Khí ra khỏi bình là O2 dư.
\(\Rightarrow n_{O_2\left(dư\right)}=\dfrac{pV}{RT}=\dfrac{0,4.11,2}{0,082.273}=0,2\left(mol\right)\)
BTNT O, có: \(n_{H_2O}=2n_{O_2}-2n_{O_2\left(dư\right)}-2n_{CO_2}=1,6\left(mol\right)\)
Có: nH2O > nCO2 nên A và b là ankan.
⇒ nankan = nH2O - nCO2 = 0,6 (mol)
Giả sử CTPT chung của A và B là: \(C_{\overline{n}}H_{2\overline{n}+2}\).
Có: n = số nguyên tử C = \(\dfrac{1}{0,6}=1,67\)
Mà: A và B là 2 ankan kế tiếp.
Nên A và B lần lượt là CH4 và C2H6.
Bạn tham khảo nhé!

Số mol 2 chất trong 2,58 g M: 
Số mol 2 chất trong 6,45 g M: 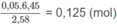
Khi đốt hỗn hợp M, thu được C O 2 và H 2 O ; vậy các chất trong hỗn hợp phải chứa C và H, có thể có O. Hai chất lại kế tiếp nhau trong một dãy đồng đẳng (nghĩa là hom nhau 1 nhóm CH2) nên công thức phân tử hai chất đó là C x H y O z và C x + 1 H y + 2 O z (x, y nguyên và > 0; z nguyên và > 0).
Giả sử trong 6,45 g M có a moi C x H y O z và b mol C x + 1 H y + 2 O z :
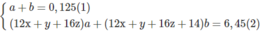
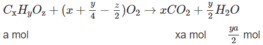
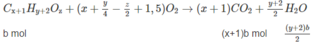
Số mol C O 2 :
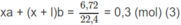
Số mol H 2 O :
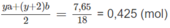
⇒ ya + (y + 2)b = 0,85 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,300
b = 0,300-0,125x
0 < b < 0,125 ⇒ 0 < 0,300 - 0,125x < 0,125
1,40 < x < 2,40
⇒ x = 2; b = 0,300 - 0,125.2 = 0,05.
⇒ a = 0,125 - 0,05 = 0,075.
Thay giá trị của a và b vào (4) ta có :
0,0750y + 0,0500(y + 2) = 0,85
⇒ y = 6.
Thay giá trị của a, b, x, y vào (2) ta tìm được z = 1.
Thành phần hỗn hợp M :
Khối lượng
C
2
H
6
O
chiếm 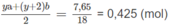
Khối lượng
C
3
H
g
O
chiếm 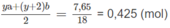
Số mol CO2=21,2822,4=0,95(mol)CO2=21,2822,4=0,95(mol)
Khối lượng C trong A là : 0,95.12 = 11,4 (g).
Số mol H2O=11,718=0,65(mol)H2O=11,718=0,65(mol)
Khối lượng H trong A là : 0,65.2 = 1,3 (g).
Tổng khối lượng của C và H chính là tổng khối lượng 2 hiđrocacbon. Vậy, khối lượng N2 trong hỗn hợp A là : 18,30 - (11,4 + 1,3) = 5,6 (g)
Số mol N2=5,628=0,2(mol)N2=5,628=0,2(mol)
Số mol 2 hidrocacbon = 11,222,4−0,2=0,3(mol)11,222,4−0,2=0,3(mol)
Đặt lượng CxHy là a mol, lượng Cx+1Hy+2 là b mol :
a + b = 0,2 (1)
Số mol C = số mol C02, do đó :
xa + (x + 1)b = 0,95 (2)
Số mol H = 2.số mol H2OH2O, do đó :
ya + (y+ 2)b = 2.0,65= 1,3
Từ (2) ta có x(a + b) + b = 0,95 ⇒⇒ b = 0,95 - 0,3x
Vì 0 < b < 0,3, nên 0 < 0,95 - 0,3x < 0,3
Từ đó tìm được 2,16 < x < 3,16 ⇒⇒ x = 3.
⇒⇒ b=0,95−3.0,3=5.10−2⇒a=0,3−0,05=0,25b=0,95−3.0,3=5.10−2⇒a=0,3−0,05=0,25
Thay giá trị tìm được của a và b vào (3), ta có y = 4.
% về khối lượng của C3H4 trong hỗn hợp A : 0,25.4018,30,25.4018,3. 100% = 54,6%
% về khối lượng của C4H6 trong hỗn hợp A : 0,05.5418,30,05.5418,3. 100% = 14,7%