Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

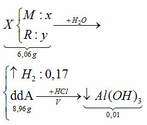
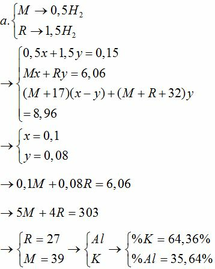
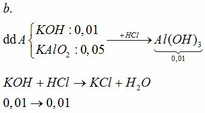
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml

1.
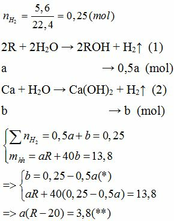
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
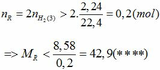
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
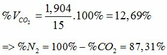
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
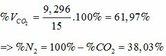

a. Số mol của CO là: nCO = 2.24/22.4=0.1 mol
Gọi x là số mol của CuO có trong hỗn hợp và y là số mol của Fe3O4 có trong hỗn hợp.
Khi cho hỗn hợp đi qua CO nung nóng thì chỉ có:
CuO + CO ----t0----> Cu+CO2
x x x
Fe3O4 + 4CO ---- to -----> 3Fe + 4CO2
y 4y 3y
Theo phương trình (1) và (2) ta có: x + 4y = 0,1 (*)
Vì Al2O3 không tham gia phản ứng với CO, do vậy hỗn hợp chất rắn thu được sau khi phản ứng gồm Al2O3, Cu và Fe.
- Phần 1: Chỉ có Fe và Al2O3 tham gia phản ứng với axit HCl theo phương trình: Fe + 2HCl ----> FeCl2 + H2
\(\dfrac{3y}{2}\) 0.03
\(\dfrac{3y}{2}\) = 0,03 (**) => y = 0,02 mol
Thay y = 0,02 vào (*), giải ra ta được x = 0,02 mol
Al2O3 + 6HCl 2AlCl3 + 3H2O
- Phần 2: Chỉ có Al2O3 tham gia phản ứng với NaOH dư.
Số mol của NaOH lúc ban đầu là: n = CM. V = 0,2 x 0,4 = 0,08 mol
Số mol của HCl là: n = CM. V = 1 x 0,02 = 0,02 mol
Vì NaOH còn dư được trung hòa với axit clohidric theo phương trình:
NaOHdư + HCl -> NaCl + H2O
0,02 0,02
Do vậy, số mol NaOH tham gia phản ứng với Al2O3 là: 0,08 – 0,02 = 0,06 mol
PTHH: Al2O3 + NaOH ------>2 NaAlO2 + H2O
0,03 0,06
Số mol Al2O3: nAl2O3 = \(\dfrac{1}{2}\) n NaOH = 0,03 mol
Số mol Al2O3 có trong hỗn hợp ban đầu là: 0,03 x 2 = 0,06 mol
b. Thành phần % khối lượng mỗi chất trong hỗn hợp ban đầu.
khối lượng của hỗn hợp là:
0,006 x 102 + 0,02 x 80 + 0,02 x 216 = 12,04 g
% Al2O3 =\(\dfrac{0.06\cdot102}{12.04}\) x100% = 50,83%
% CuO = \(\dfrac{0.02\cdot80}{12.04}\) x100% = 13,29%
% Fe3O4 = \(\dfrac{0.02\cdot216}{12.04}\)x100% = 35,88%
Vì Cu không tác dụng được với HCl -> chất rắn
\(m_{hh}=5,12-1,92=3,2\left(g\right)\)
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
\(n_{HCl}=0,15.2=0,5\left(mol\right)\)
Pt: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)(1)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (2)
\(n_{HCl}:n_{H_2}=0,25>0,08\)
H2 hết; HCl dư
Gọi x, y lần lượt là số mol của Mg, Fe
(1)(2) \(\Rightarrow\left\{{}\begin{matrix}24x+56y=3,2\\x+y=0,08\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,04\\y=0,04\end{matrix}\right.\)
\(m_{Mg}=0,04.24=0,96\left(g\right)\)
\(m_{Fe}=3,2-0,96=2,24\left(g\right)\)
c) \(n_{Cu}=\dfrac{1,92}{64}=0,03\left(mol\right)\)
Pt: \(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
0,03mol-------------------------- \(\rightarrow0,03mol\)
\(V_{SO_2}=0,03.22,4=0,672\left(l\right)\)

Có: nH2SO4 \(=\frac{4,9}{98}=0,05\left(mol\right)\)
Vì: \(x_1+H2S\text{O4}\rightarrow X_2+X_3\) nên X1 có thể là: oxit bazo, oxit lưỡng tính, bazo, hidroxit lưỡng tính, muối. Nhưng vì bài cho X1 có thể là CaO,MgO,NaOH,KOH,Zn và Fe nên loại các trường hợp oxit lưỡng tính, hidroxit lưỡng tính, muối.
TH1: X1 là oxit bazo: CaO,MgO.
Gọi CTPT chung cho X1 là MgO.
PTPU:
MO + H2SO4 → MSO4 + H2O (*) mol
0,05 0,05 0,05
Vậy KL mol của MO là: \(M_{MO}=\frac{2,8}{0,05}=56\left(g\right)\)
Vậy MO là CaO
TH2: Xét X1 là bazo: NaOH, KOH
Gọi CTPT chung cho X1 là MOH.
PTPƯ: 2MOH + H2SO4 → M2SO4 + 2H2SO4 (**)
0,1 0,05 0,05
Vậy KL mol của MOH là: \(M_{MOH}=\frac{2,8}{0,1}=28\left(g\right)\) (không có MOH thỏa mản)
TH3: X1 kim loại Zn và Fe. Gọi CTCP chung cho X1 là M.
PTPU: M + H2SO4 → MSO4 + H2 (***)
0,05 0,05 0,05
Vậy KL mol MO là \(M_M=\frac{2,8}{0,05}=56\left(g\right)\). Vậy M là Fe.
b. X1 là CaO thì X2 là \(m_{CaS\text{O4}}=0,05.136=6,8\left(g\right)\)
(khác bài ra 7,6 g) loại.
X1 là kim loại Fe thì X2 \(m_{FeS\text{O4}}=0,05.152=7,6\left(g\right)\) phù hợp với đề bài như vậy X3 là H2

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

a)
$RCO_3 + 2HCl \to RCl_2 + CO_2 + H_2O$
$R_2(CO_3)_3 + 6HCl \to 2RCl_3 + 3CO_2 + 3H_2O$
b)
Theo PTHH :
$n_{H_2O} = n_{CO_2} = \dfrac{0,672}{22,4} = 0,03(mol)$
$n_{HCl} = 2n_{CO_2} = 0,06(mol)$
Bảo toàn khối lượng :
$m_{muối} = 10 + 0,06.36,5 - 0,03.44 - 0,03.18 = 10,33(gam)$



Công thức muối là Na2CO3 nhé !
Gọi CTHH của muối là R2CO3
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\n_{BaSO_4}=\dfrac{46,6}{233}=0,2\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{BaCO_3}=n_{BaSO_4}=0,2\left(mol\right)=n_{CO_2\left(BaCO_3\right)}\\n_{R_2CO_3}=n_{CO_2\left(còn.lại\right)}=0,3-0.2=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{R_2CO_3}=0,1\cdot\left(2R+60\right)=50-0,2\cdot197=10,6\left(g\right)\)
\(\Rightarrow R=23\)
Vậy kim loại cần tìm là Natri