
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

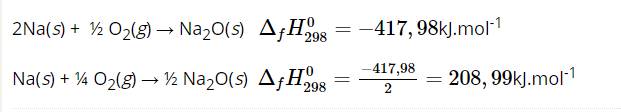

2Na(s) + ½ O2(g) → Na2O(s) ${\Delta _f}H_{298}^0 = - 417,98$kJ.mol-1
Na(s) + ¼ O2(g) → ½ Na2O(s) ${\Delta _f}H_{298}^0 = \frac{{ - 417,98}}{2} = 208,99$kJ.mol-1

Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.

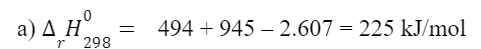
b) Trong N2, liên kết giữa 2 nguyên tử là liên kết ba – một loại liên kết bển, cần 1 năng lượng rất lớn để phá vỡ liên kết đó.
=> N2 khá trơ về mặt hóa học và chỉ phản ứng với oxy khi có nhiệt đô cao hoặc có tia lửa điện

Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.

nNaOH/nSO2 = 0.8/1 = 0.8 < 1
=> chỉ có pứ tạo muối axit là NaHSO3, SO2 dư => cô cạn dung dịch ở áp suất nhiệt độ thấp => thu được NaHSO3
Chọn C