
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

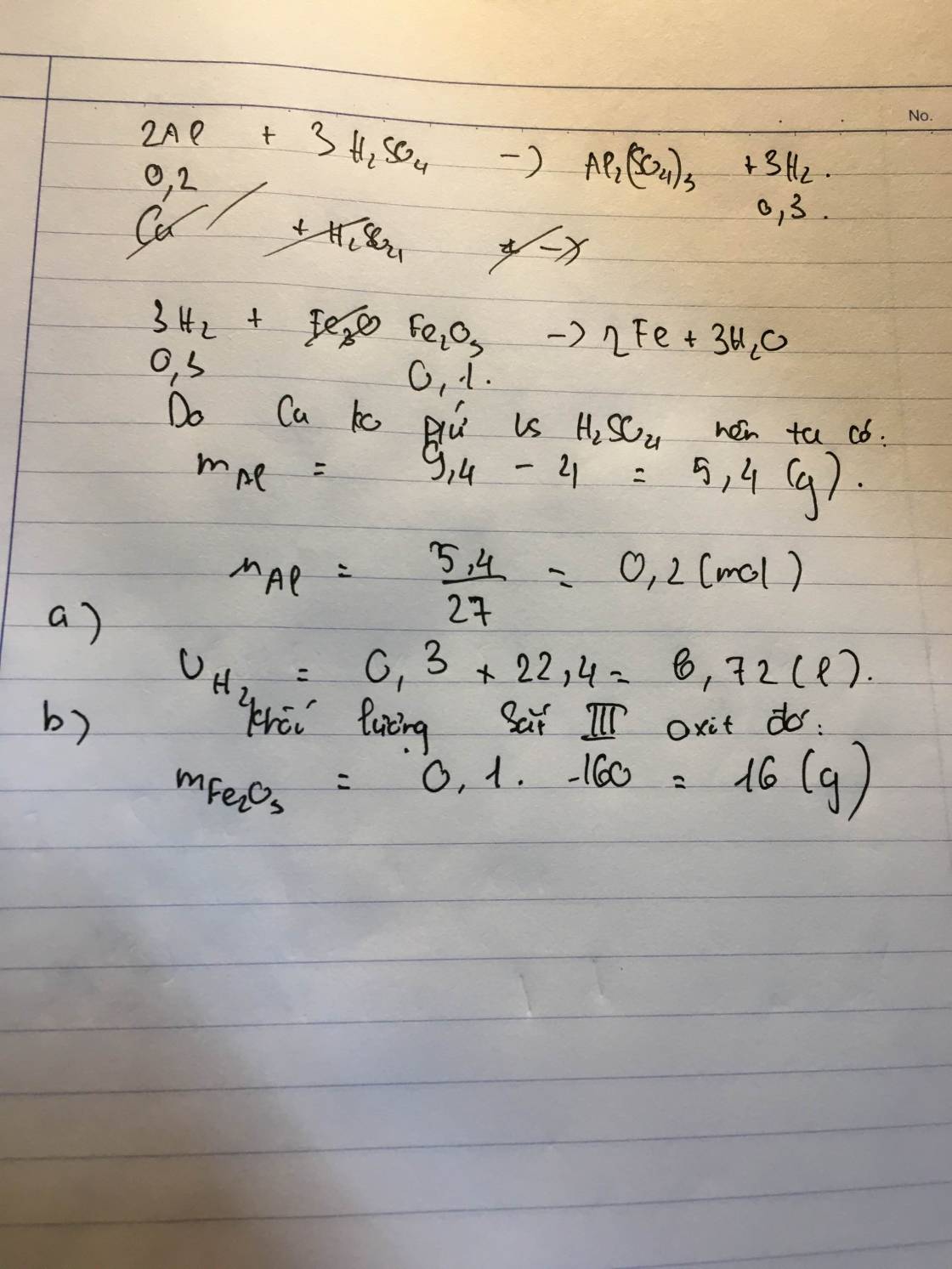

a, nZn = 26/65 = 0,4 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
nZn = nH2 = 0,4 (mol)
VH2 = 0,4 . 22,4 = 8,96 (l)
b, nFe2O3 = 16/160 = 0,1 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
LTL: 0,1 < 0,4/3 => H2 dư
nFe = 0,1 . 3 = 0,3 (mol)
mFe = 0,3 . 56 = 16,8 (g)
a) \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,4--------------------->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{3}\) => Fe2O3 hết, H2 dư
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1---------------->0,2
=> mFe = 0,2.56 = 11,2 (g)

a,\(n_{Mg}=\dfrac{9,6}{24}=0,4\left(mol\right);n_{H_2SO_4}=1,5.0,2=0,3\left(mol\right)\)
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,3 0,3 0,3
Ta có: \(\dfrac{0,4}{1}>\dfrac{0,3}{1}\) ⇒ Mg dư, H2SO4 pứ hết
\(m_{MgSO_4}=0,3.120=36\left(g\right)\)
b,\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
c, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
PTHH: 3H2 + Fe2O3 → 2Fe + 3H2O
Mol: 0,04 0,08
Ta có: \(\dfrac{0,3}{3}>\dfrac{0,04}{1}\) ⇒ H2 dư, Fe2O3 pứ hết
\(\Rightarrow m_{Fe}=0,08.56=4,48\left(g\right)\)

PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
a, \(n_{Fe}=2n_{Fe_2O_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
b, \(n_{H_2}=3n_{Fe_2O_3}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
c, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{Mg}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{Mg}=0,3.24=7,2\left(g\right)\)

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2\)
Theo PTHH : \(n_{Zn} = n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\)
\(\Rightarrow n_{Fe_2O_3} = \dfrac{35,5-0,3.65}{160} = 0,1\\ \Rightarrow n_{HCl} = 2n_{Zn} + 6n_{Fe_2O_3} = 0,3.2 + 0,1.6 = 1,2(mol)\\ \Rightarrow m_{HCl} = 1,2.36,5 = 43,8(gam)\)
b)
\(CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\)
Gọi \(n_{CuO} = a;n_{Fe_2O_3} = b\)
\(\left\{{}\begin{matrix}80a+160b=19,6\\a+3b=0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,135\\b=0,055\end{matrix}\right.\)
Vậy :
\(\left\{{}\begin{matrix}n_{Cu}=0,135\\n_{Fe}=0,055.2=0,11\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Cu}=0,135.64=8,64\left(gam\right)\\m_{Fe}=0,11.56=6,16\left(gam\right)\end{matrix}\right.\)

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 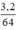 = 0,05 mol
= 0,05 mol
nFe = 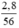 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 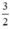 . nFe =
. nFe = 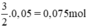 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

a)
$Zn + 2HCl \to ZnCl_2 + H_2$
$Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O$
Theo PTHH : $n_{Zn} = n_{H_2} = 0,06(mol)$
$\Rightarrow n_{Fe_2O_3} = \dfrac{7,1-0,06.65}{160} = 0,02(mol)$
Theo PTHH : $n_{HCl} = 2n_{Zn} + 6n_{Fe_2O_3} = 0,24(mol)$
$m_{HCl} = 0,24.36,5 = 8,76(gam)$
b)
Gọi $n_{CuO} = x(mol) ; n_{Fe_3O_4} = y(mol) \Rightarrow 80a + 232y = 3,92(1)$
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
Theo PTHH : $n_{H_2} =x + 4y = 0,06(2)$
Từ (1)(2) suy ra: x = 0,02; y = 0,01
$n_{Cu} = 0,02(mol) \Rightarrow m_{Cu} = 0,02.64 = 1,28(gam)$
$n_{Fe} = 0,01.3 = 0,03(mol) \Rightarrow m_{Fe} = 0,03.56 = 1,68(gam)$

PT: \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
Ta có: \(n_{FeO}=\dfrac{7,2}{72}=0,1\left(mol\right)\)
a, Theo PT: \(n_{Fe}=n_{FeO}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
b, Theo PT: \(n_{H_2}=n_{FeO}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
THeo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Al}=\dfrac{1}{15}.27=1,8\left(g\right)\)

a)
\(2Cu + O_2 \xrightarrow{t^o} 2CuO\)
b)
\(n_{CuO} = n_{Cu} = \dfrac{6,4}{64} = 0,1(mol)\\ \Rightarrow m_{CuO} = 0,1.80 = 8(gam)\)
c)
\(n_{O_2} = \dfrac{1}{2}n_{Cu} = 0,05(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ m_{KMnO_4} = 2n_{O_2} = 0,05.2 = 0,1.158 = 15,8(gam)\)
d)
\(V_{không\ khí} = 5V_{O_2} = 0,05.22,4.5 = 5,6(lít)\)