Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hòa tan hỗn hợp 1,69g Oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được Vml dung dịch KOH 1M. Giá trị của V là:
A.20
B.40
C.30
D.10
Giải thích:
\(H2SO4.3SO3+H2O=4H2SO4\)
\(n\left(o\le um\right)=0.005mol\)
\(\Rightarrow nH2SO4=0.005.4=0.02mol\)
\(H2SO4+2KOH=K2SO4+H2O\)
\(\Rightarrow nKOH=0.04\)
\(\Rightarrow\) Giá trị của V là: 40

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
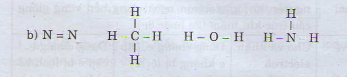
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

áp dụng công thức
v = ΔC\Δt = 0,22 - 0,1 \ 4 = 0,03 (M\s)�‾=Δ�Δ�=0,22−0,14=0,03(��)

Xét hiệu độ âm điện các nguyên tố trong phân tử, ta có:
\(PH_3\): \(2,20-2,19=0,01< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(H_2S\): \(2,58-2,20=0,38< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(NH_3\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(BeCl_2\): \(3,16-1,57=1,59>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HF:\) \(3,98-2,20=1,78>1,7\text{ }\Rightarrow\) Liên kết ion
\(BF_3:\) \(3,98-2,04=1,94>1,7\text{ }\Rightarrow\) Liên kết ion
\(LiF:\) \(3,98-0,98=3,00>1,7\text{ }\Rightarrow\) Liên kết ion
\(ClO_2\): \(3,44-3,16=0,28< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.

1. So sánh tính kim loại của sodium và magnesium
1. Phương trình hóa học2Na + 2H2O -> 2NaOH + H2
2. Ở điều kiện thường:
- Sodium phản ứng mãnh liệt với nước, tạo dung dịch màu hồng và tỏa nhiệt.
- Magnesium không phản ứng với nước.
2. So sánh tính phi kim của chlorine và iodine
- Hiện tượng: Dung dịch không màu chuyển thành màu nâu của Iodine
=> Cl đẩy được I ra khỏi dung dịch KI => Tính phi kim của iodine yếu hơn chlorine

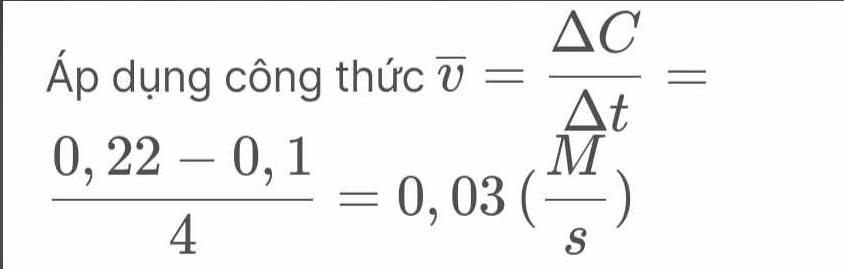


1.Phân tử nào có liên kết cộng hóa trị không cực ?
A. HCl. B. Cl2. (CHỌN B) C. NH3. D. H2O.
2.Liên kết cộng hóa trị có cực tạo thành giữa hai nguyên tử
A. phi kim khác nhau. B. cùng một phi kim điển hình.
C. phi kim mạnh và kim loại mạnh. (Theo anh nhớ là vậy C á) D. kim loại và kim loại.