Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 24: Nhóm kim loại đều tác dụng với nước là:
A. Na , Ba, Ca , K | B. Li , Na , Cu , K | C. K , Na , Ba , Al | D. Ca , Na , Fe, K |
Câu 25: Cho thanh Al ngâm vào dung dịch axit clohidric thấy có khí bay lên. Xác định khí đó là
A. Cl2 | B. NH3 | C. H2O | D. H2 |

| Chất | Số mol(n) | khối lượng (m) | Vđiều kiện tiêu chuẩn | Sốphân tử |
| O2 | 32 | 6,022.1023 | ||
| N2 | 28 | 6,72L | ||
| NH2 | 34 | |||
| H2SO4 | 0,5 | 49 | ///////////////////////////// | |
| Fe(SO4)3 | //////////////////////////// | |||
| CuO | 80 |

1.
- nFe= \(\dfrac{11,2}{56}\) = 0,2 mol
nAl = \(\dfrac{m}{27}\) mol
- Khi thêm Fe vào cốc đựng dd HCl (cốc A) có phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 +H2 \(\uparrow\)
0,2 0,2
- Theo định luật bảo toàn khối lượng, khối lượng cốc đựng HCl tăng thêm:
11,2 - (0,2.2) = 10,8g
- Khi thêm Al vào cốc đựng dd H2SO4 có phản ứng:
2Al + 3 H2SO4 \(\rightarrow\) Al2 (SO4)3 + 3H2\(\uparrow\)
\(\dfrac{m}{27}\) mol \(\rightarrow\) \(\dfrac{3.m}{27.2}\)mol
- Khi cho m gam Al vào cốc B, cốc B tăng thêm m - \(\dfrac{3.m}{27.2}\)
- Để cân thăng bằng, khối lượng ở cốc đựng H2SO4 cũng phải tăng thêm 10,8g. Có: m - \(\dfrac{3.m}{27.2}.2\) = 10,8
- Giải được m = (g)
2.
PTPƯ: CuO + H2 \(\underrightarrow{400^oC}\) Cu + H2O
Nếu phản ứng xảy ra hoàn toàn, lượng Cu thu được \(\dfrac{20.64}{80}=16g\)
16,8 > 16 => CuO dư.
Hiện tượng PƯ: Chất rắn dạng bột CuO có màu đen dần dần chuyển sang màu đỏ (chưa hoàn toàn).
Đặt x là số mol CuO PƯ, ta có mCR sau PƯ = mCu + mCuO còn dư
= mCu + (mCuO ban đầu – mCuO PƯ)
64x + (20-80x) =16,8 \(\Leftrightarrow\) 16x = 3,2 \(\Leftrightarrow\) x= 0,2.
nH2 = nCuO= x= 0,2 mol. Vậy: VH2= 0,2.22,4= 4,48 lít
3.
2KClO3 \(\rightarrow\) 2KCl + 3O2
\(\dfrac{a}{122,5}\) \(\rightarrow\) \(\dfrac{a}{122,5}\left(74,5\right)\) + \(\dfrac{3a}{2}.22,4\)
2KMnO4 \(\rightarrow\) K2MnO4 + MnO2 + O2
\(\dfrac{b}{158}\) \(\rightarrow\) \(\dfrac{b}{2.158}197\) + \(\dfrac{b}{2.158}87\) + \(\dfrac{b}{2}22,4\)
\(\dfrac{a}{122,5}74,5=\dfrac{b}{2.158}197+\dfrac{b}{2.158}87\)
\(\dfrac{a}{b}=\dfrac{122,5\left(197+87\right)}{2.158.74,5}\approx1,78\)
\(\dfrac{3a}{2}.22,4:\dfrac{b}{2}.22,4=3\dfrac{a}{b}\approx4,43\)

tổng số hạt=2Z+N=34\(\Rightarrow\)N=34-2Z
Ta có Z\(\le\)N\(\le\)1,5Z\(\Rightarrow\)3,714\(\le\)Z\(\le\)4,333
\(\rightarrow\)Z=4: N=5
MX=1,6726 . 10-27. 4+1,6747 . 10-27.5+9,11.10-31 . 4= 1,5068.10-26
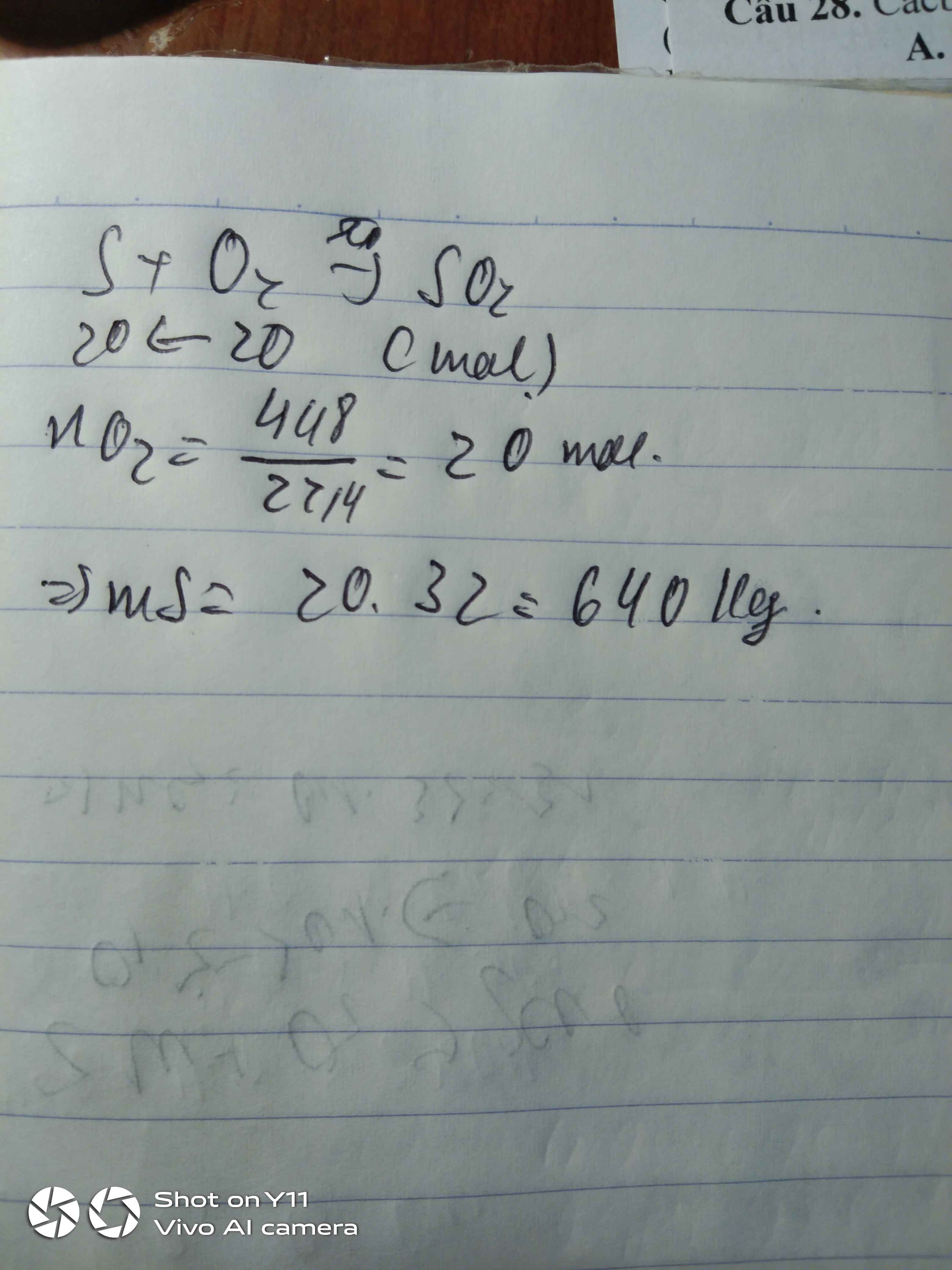
Câu 1:
nKClO3=12,25122,5=0,1mol
2KClO3→(to,MnO2)2KCl+3O2
0,1 0,15 ( mol )
VO2=0,15.22,4=3,36l
=> Chọn B