Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Số mol nguyên tử C, H, O trong 1,5 mol đường
Trong 1,5 mol đường có 18 mol C, 33 mol H và 16,5 mol O
b) Khối lượng mol đường:
= 12 . 12 + 22 . 1 + 16 . 11 = 342 g
c) Trong đó:
mC = 12 . 12 = 144 g; mH = 22 g; mO = 11 . 16 = 176 g

a) Trong 1 mol phân tử C12H22O11 có 12 mol nguyên tử C, 22 mol nguyên tử H, 11 mol nguyên tử O. Do đó trong 1,5 mol phân tử C12H22O11 có số mol các nguyên tử của nguyên tố là:
nC = 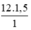 = 18 mol nguyên tử cacbon.
= 18 mol nguyên tử cacbon.
nH = 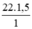 = 33 mol nguyên tử H.
= 33 mol nguyên tử H.
nO = 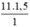 = 16,5 mol nguyên tử O.
= 16,5 mol nguyên tử O.
b) Khối lượng mol đường:
MC12H22O11 =12.MC + 22.MH + 11.MO = 12.12 + 1.22 +16.11= 342 g/mol.
c) Trong 1 mol phân tử C12H22O11 có khối lượng các nguyên tố.
mC = 12 . 12 = 144g.
mH = 1 . 22 = 22g.
mO = 16 . 11 = 176g.

- Giả sử : %mR = a%
\(\Rightarrow\) %mO =\(\dfrac{3}{7}\) a%
- Gọi hoá trị của R là n
\(\Rightarrow\) Đặt CTTQ của B là: R2On
Ta có :
\(2:n=\dfrac{a\text{%}}{R}:\dfrac{\dfrac{3}{7}\%a}{16}\Rightarrow R=\dfrac{112n}{6}\)
- Vì n là hóa trị của nguyên tố nên n phải nguyên dương, ta có bảng sau :
|
n |
I |
II |
III |
IV |
|
R |
18,6 |
37,3 |
56 |
76,4 |
|
|
loại |
loại |
Fe |
loại |
=> R là Fe
- Vậy công thức hóa học của B là Fe2O3 .
Bài 1 :
Gọi công thức hợp chất : R2On ; 1 ≤ n ≤ 3
Theo gt: %R + %O = 100%
\(\%R+\dfrac{3}{7}\%R=\dfrac{10}{7}\%R\)
Mà %R + %O = 100
\(\Rightarrow\left\{{}\begin{matrix}\%R=70\%\\\%O=30\%\end{matrix}\right.\)
\(\dfrac{M_R}{70}=\dfrac{M_O}{30}\)
\(\Leftrightarrow\dfrac{2M_R}{70}=\dfrac{16n}{30}\)
\(\Leftrightarrow60M_R=1120n\)
\(\Leftrightarrow M_R=\dfrac{56n}{3}\)
| n | 1 | 2 | 3 |
| MR | \(\dfrac{56}{3}\) | \(\dfrac{112}{3}\) | 56 |
Vậy công thức hợp chất là Fe2O3

XX có 4 lớp electron.
Ta có lớp 1 có tối đa 2 ee.
Lớp 2 có tối đa 8 ee.
Lớp 3 có tối đa 18 ee.
Lớp 4 của nguyên tố này có 7 ee
Do vậy XX chứa số ee là
eX=2+8+18+7=35eX=2+8+18+7=35
Trong một nguyên tử ta luôn có:
pX=eX=35pX=eX=35
Trong nguyên tử, hạt mang điện là p;ep;e; không mang điện là nn
→np+e=n35.2=0,6429→n=45→np+e=n35.2=0,6429→n=45
Hạt nhân của XX chứa 35 pp nên điện tích hạt nhân là 35+.
Số khối của XX
Nguyên tố RR có số nn là
AX=p+n=35+45=80 (u)AX=p+n=35+45=80 (u)
nR=53,143%pX=18,6nR=53,143%pX=18,6 (phần này xem lại đề)
Câu cc hỏi cấu tạo nguyên tử gì em??
Nếu là XX thì cấu tạo như này
Câu tạo của XX có 4 lớp e và 7e ngoài cùng.

Bài 9 :
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Đặt x, y lần lượt số mol Mg , Zn phản ứng với axit
PTHH :
\(Mg\left(x\right)+H_2SO_4\left(x\right)-->MgSO_4\left(x\right)+H_2\left(x\right)\)
\(Zn\left(y\right)+H_2SO_4\left(y\right)-->ZnSO_4\left(y\right)+H_2\left(y\right)\)
Gỉa sử trong hỗn hợp chỉ có Zn :
\(x+y=n_{Zn}=n_{H_2}=0,1\)
\(\Rightarrow m_{Zn}=0,1.65=6,5\left(g\right)\)
\(\Rightarrow65x+65y=65\left(x+y\right)=6,5\left(g\right)< 7,8\left(g\right)\)
Vậy chứng tỏ axit vẫn dư sau phản ứng .
Bài 7 :
PTHH :
\(Fe+2HCl-->FeCl_2+H_2\left(1\right)\)
\(2Al+6HCl-->2AlCl_3+3H_2\left(2\right)\)
Gỉa sử trong hỗn hợp X chỉ có Fe :
\(n_{Fe}=\dfrac{22}{56}=0,4\left(mol\right)\Rightarrow n_{HCl}=0,4.2=0,8\left(mol\right)\)
\(n_{HCl}=0,6\left(mol\right)< 0,8\left(mol\right)\)
Chứng tỏ kim loại không tan hết .(1)
\(Gỉa\) sử trong hỗn hợp chỉ có Al :
\(n_{Al}=\dfrac{22}{27}=0,814=>n_{HCl}=3.0,814=2,44\left(mol\right)>0,6\left(mol\right)\)
Chứng tỏ kim loại không tan hết (2)
Từ (1),(2) chứng tỏ hh X không tan hết .
HÌNH NHƯ SAI ĐỀ .

a) Hợp chất A có khối lượng mol phân tử là 58,5 g/mol, thành phần các nguyên tố theo khối lượng: 60,68% Cl và còn lại là Na.
b) Hợp chất B có khối lượng mol phân tử là 106 g/mol, thành phần các nguyên tố theo khối lượng: 43,4% Na; 11,3% C; 45,3% O
Bài giải:
a) Ta có:
MA = 58,5 g
%Cl = 60,68% => %Na = 39,32%
=> MCl = = 35,5 đvC => nCl = 1 mol
=> MNa = = 23 đvC => nNa = 1 mol
Vì Na hóa trị I và Cl hóa trị 1 nên CTHH: NaCl
b) Ta có:
MB =106 g
MNa = = 46 => nNa =
= 2 mol
MC = = 12 => nC = 1 mol
MO = = 48 => nO =
= 3 mol
Suy ra trong một phân tử hợp chất B có 2 nguyên tử Na, 1 nguyên tử C và 3 nguyên tử O
Do đó công thức hòa học của hợp chất B là Na2CO3
a) Ta có:
MA = 58,5 g
%Cl = 60,68% => %Na = 39,32%
=> MCl = = 35,5 đvC => nCl = 1 mol
=> MNa = = 23 đvC => nNa = 1 mol
Vì Na hóa trị I và Cl hóa trị 1 nên CTHH: NaCl
b) Ta có:
MB =106 g
MNa = = 46 => nNa =
= 2 mol
MC = = 12 => nC = 1 mol
MO = = 48 => nO =
= 3 mol
Suy ra trong một phân tử hợp chất B có 2 nguyên tử Na, 1 nguyên tử C và 3 nguyên tử O
Do đó công thức hòa học của hợp chất B là Na2CO3

Bài 1:
Theo giả thiết ta có : các pthh
+ Khi khử hh oxit sắt thì có PT PƯ sau :
\(\left(1\right)Fe2O3+3H2-^{t0}\rightarrow2Fe+3H2O\)
\(\left(2\right)FeO+H2-^{t0}\rightarrow Fe+H2O\)
+ Khi cho hh sắt thu được ở trên t/d với HCl ta có PT P/Ư sau :
(3) \(Fe+2HCl\rightarrow FeCl2+H2\)
0,2mol<--0,4mol------------>0,2 mol
a) Gọi x mol là số mol của Fe thu được ở PƯ 1
Số mol của Fe thu được ở PƯ 2 là 0,2-x mol
Theo pt pư 1 và 2 ta có :
nFe2O3=1/2nFe=1/2x mol
nFeO=nfe=0,2-x mol
Theo giả thiết ta có PT :
160.1/2x + 72(0,2-x) = 15,2
Giải ra ta được x = 0,1 mol
=> nFe2O3=1/2.0,1=0,05 mol
nFeO = 0,2-0,1=0,1 mol
=> %mFe2O3=\(\dfrac{\left(0,05.160\right).100}{15,2}\approx52,63\%\)
%mFeO = 100% - 52,63% = 47,37%
b) Thể tích khí hidro thu được là :
VH2(dktc) = 0,2.22,4=4,48 (l)

Anh công nhá học sinh giỏi lên hỏi ak !
ko
hỏi cho mấy đứa nó trả lời vui thôi