Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học của phản ứng:
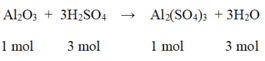
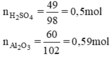
So sánh tỉ lệ 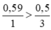 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
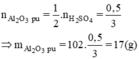
mAl2O3 (dư) = 60 - 17 = 43(g)

`a)`
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,4` `0,4` `0,4` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`b)m_[FeSO_4]=0,4.152=60,8(g)`
`c)V_[H_2]=0,4.22,4=8,96(l)`

\(a,n_{Fe}=\dfrac{22,4}{56}=0,4(mol)\\ n_{H_2SO_4}=\dfrac{24,5}{98}=0,25(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ LTL:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe\text{ dư}\\ n_{Fe(dư)}=0,4-0,25=0,15(mol)\\ \Rightarrow m_{Fe(dư)}=0,15.56=8,4(g)\\ \)
\(b,m_{dư}=m_{Fe(dư)}=8,4(g)\\ c,n_{H_2}=0,25(mol)\\ \Rightarrow V_{H_2}=0,25.22,4=5,6(l)\\ d,n_{FeSO_4}=0,25(mol)\\\Rightarrow m_{FeSO_4}=0,25.152=38(g)\)

Fe + H2SO4 -> FeSO4 + H2
nFe=0,5(mol)
Theo PTHH ta có:
nFeSO4=nFe=nH2=nH2SO4=0,5(mol)
mFeSO4=152.0,5=76(g)
VH2=22,4.0,5=11,2(lít)
Cách 1:
mH2SO4=98.0,5=49(g)
Cách 2:
Theo ĐLBTKL ta có:
mFe + mH2SO4=mFeSO4+mH2
=>mH2SO4=76+0,5.2-28=49(g)

Bài 1
Sắt tác dụng với dung dịch CuSO4 theo phương trình:
Fe + CuSO4 ---------> FeSO4 + Cu
Nếu cho 11,2 g sắt vào 40 g CuSO4. Tính khối lượng Cu thu được sau phản ứng.
----------
1. \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{CuSO_4}=\dfrac{40}{160}=0,25\left(mol\right)\)
Pt: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,2mol 0,25mol \(\rightarrow\) 0,2mol
Lập tỉ số: \(n_{Fe}:n_{CuSO_4}=0,2< 0,25\)
Fe hết, CuSO4 dư
\(m_{Cu}=0,2.64=12,8\left(g\right)\)
Bài 2
Cho sắt tác dụng với dd axit H2SO4 theo sơ đồ sau:
Fe + H2SO4 ---------> FeSO4 + H2
Có 22,4 g sắt tác dụng với 24,5 g H2SO4. Tính:
a) Thể tích khí H2 thu được ở đktc.
b) Khối lượng các chất còn lại sau phản ứng.
------------------------------
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
Pt: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,4mol 0,25mol\(\rightarrow\) 0,25mol\(\rightarrow\)0,25mol
Lập tỉ số: \(n_{Fe}:n_{H_2SO_4}=0,4< 0,25\)
Fe dư, H2SO4 hết
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
\(n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(m_{Fe\left(dư\right)}=0,15.56=8,4\left(g\right)\)
\(m_{FeSO_4}=0,25.152=38\left(g\right)\)
nFe3O4=m/M=3,84/232\(\approx0,017\)(mol)
nH2SO4=m/M=3,92/98=0,04(mol)
pthh:
Fe3O4 + 4H2SO4 -> FeSO4 + Fe2(SO4)3 + 4H2O
1...............4..................1................1....................4 (mol)
0,01 <-0,04 -> 0,01 -> 0,01 ->0,04 (mol)
Muối tạo thành là FeSO4 và Fe2(SO4)3
=> mFeSO4=n.M=0,01.152=1,52(g)
\(m_{Fe_2\left(SO_4\right)_3}=n.M=0,01.400=4\left(g\right)\)
b) Theo câu b thì
=> md d H2SO4=\(\dfrac{m_{H_2SO_4}.100\%}{C\%}=\dfrac{0,04.98.100}{19,6}=20\left(g\right)\)
=> md d sau phản ứng =mFe3O4 +mH2SO4=3,84+20=23,84(g)
=> \(C\%_{FeSO_4}=\dfrac{m_{FeSO_4}.100\%}{m_{ddsauphanung}}=\dfrac{1,52.100}{23,84}=\approx6,38\left(\%\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{m_{Fe_2\left(SO_4\right)_3}.100\%}{m_{ddsauphanung}}=\dfrac{4.100}{23,84}\approx16,77\left(\%\right)\)