Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

pt chuyển pha HCN=HCN
a/s hơi bão hòa Phbh phụ thuộc vào nhiệt độ T theo pt
lgP(mmHg) = 7,04 - 1237/T
\(\Rightarrow\) lnP(mmHg)=lgP(mmHg)/ln(10)=16,21-2848,3/T (1)
xét trong khoảng nhiệt độ tương đối hẹp ta có pt:
lnP=\(\frac{-\lambda}{RT}\)+j (2)
từ (1),(2) suy ra: \(\lambda\) =2848,3. 1,987=5659 ( cal/mol)
ở đk thường, P=1atm= 760mmHg\(\Rightarrow\)lg(760)=7,04-1237/T\(\Rightarrow\)T=297,4K=24,4oC
TTrong khoảng nhiệt độ tương đối hẹp nên: lnP = - \(\frac{\lambda}{RT}\) + C
Ta có : lgP = 7.04 - \(\frac{1237}{T}\) => lnP = (7.04 - \(\frac{1237}{T}\)) ln10
=> \(\frac{-\lambda}{R}\) = - 1237 . ln10 => nhiệt hóa hơi: \(\lambda\) = 1237 . ln10 . R = 1237 . ln10 . 1.987 = 5659,57 (cal/mol)
nhiệt độ sôi của chất lỏng là nhiệt độ tại P = 1atm = 760 mmHg
=> nhiệt độ sôi: \(T_s\) = \(\frac{1237}{7.04-lgP}\) = \(\frac{1237}{7.04-lg760}\) = 297.41 K

Bạn nên tách ra thành 2 câu hỏi riêng biệt cho từng bài.
Bài 1.
a) Dung dịch CaCl2 bão hòa có độ tan là 23,4 g, tức là trong 100 g H2O thì có 23,4 gam CaCl2.
Như vậy, khối lượng dung dịch là 123,4 gam. Suy ra C% = 23,4.100%/123,4 = 18,96%.
b) Khối lượng dung dịch = d.V = 1,2V (g). Khối lượng chất tan = 98.số mol = 98.V/1000.CM = 98.V.0,5/1000 (g). Suy ra, C% = 98.0,5.100%/1,2.1000=4,08%.
c) m(dd) = 1,3V (g); khối lượng chất tan của NaOH = 40.V/1000 (g); khối lượng chất tan của KOH = 56.0,5V/1000 (g).
C%(NaOH) = 40V.100%/1,3V.1000 = 3,08%; C%KOH = 2,15%.
Bài 3.
a) C% = 50.100%/150 = 100/3 = 33,33%.
b) Ở 90 độ C, C% của NaCl là 33,33% nên trong 600 g dung dịch sẽ có 600.33,33% = 200 g chất tan NaCl. Như vậy có 400 g dung môi là H2O.
Khi làm lạnh đến 0 độ C thì C% NaCl là 25,93% nên có 140 g NaCl. Vì vậy khối lượng dung dịch sẽ là 400 + 140 = 540 g.

Chọn đáp án C
R là Natri (Na) và M là Nhôm (Al). Do số mol H2 ở 2 thí nghiệm khác nhau.
• phần 1: Al dư. Quy V lít về V mol. Xét phần 1 : Do Al dư ⇒ nAl phản ứng = nNa
⇒ Bảo toàn electron: nNa + 3nNa = 2nH2 ⇒ nNa = 2V ÷ 4 = 0,5V mol.
• Phần 2: NaOH dư ⇒ Al phản ứng hết. Bảo toàn electron:
nNa + 3nAl = 2nH2 ⇒ 0,5V + 3nAl = 2 × 1,45V ⇒ nAl = 0,8V mol.
⇒ nR : nM = 0,5 : 0,8 = 5 : 8

10(g) H2O(L)-----------------H2O(H)
Nhiệt của quá trình là:Q=10x2415.824=24158.24(J)
Theo điều kiện đề bài cho:hơi nước như khí lý tưởng
giả sử quá trình tiến hành ở điều kiện áp suất thường p=1atm,Ta có
PV=nRT =>V=nRT/P=10x0.082x293/18x1=13.35(l)
Công của quá trình là công giãn nở thể tích trong điều kiện đẳng áp
A=P(VH-VL)=1X13.35(J)
Nội năng =Q-A=24158.24-13.35=24144.9(J)
-Công của sự giản nở khí lý tưởng từ thể tích V1 đến V2 ở nhiệt độ không đổi :
A=-P(V2-V1)=-PΔV=-P(Vh-Vl)=-PVh (1)
-Theo phương trình trạng thái khí lý tưởng ,ta có:
PV=nRT =>V=\(\frac{m}{M}.\frac{RT}{P}=\frac{10}{18}.\frac{0,082.293}{1}=13,35\left(l\right)\left(2\right)\)
Thay(2) vào (1) ta có: A=-13,35.1atm=-13,35.24,2(cal)=-13,35 .24,2 .4,1858(J)=-1352,31(J)
-Q=\(\lambda_{hh}.10=24518,24\left(J\right)\)
-Biến thiên nội năng ΔU Khi làm bay hơi 10 g nước :
ΔU=Q+A
=24518,24-1352,31=23165,93(J).

Ta có mC = 0,75m (gam) > 0,7m (gam)
\(\Rightarrow\) trong C có Fe dư
\(\Rightarrow\) HNO3 hết, trong B chỉ chứa muối Fe(NO3)2
PT:
Fe + 4HNO3 \(\rightarrow\)Fe(NO3)3 + NO + 2H2O
Fe + 6HNO3 \(\rightarrow\) Fe(NO3)3 + 3NO2 + 3H2O
Fe + 2Fe(NO3)3 \(\rightarrow\) 3Fe(NO3)2
Ta có : \(n_{hh}=\frac{2,87.1,2}{0,082.\left(273+27\right)}=0,14mol\)
\(\Rightarrow\) số mol HNO3 tạo muối = 0,44 – 0,14 = 0,3 (mol)
\(\Rightarrow\) \(n_{Fe\left(NO_3\right)_2}=0,15mol\)
\(\Rightarrow\) Khối lượng muối trong B = 0,15.180 = 27 (gam)
\(\Rightarrow\) nFe (pu) = 0,15 (mol) => mFe(pu) = 0,15.56 = 8,4 (gam)
\(m=\frac{8,4.100}{25}=33,6\left(g\right)\)

Gọi số mol K và Al trong hỗn hợp x, y
2K + 2H2O → KOH + H2 (1)
x x (mol)
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
y y (mol)
Do x tan hết nên Al hết, KOH dư sau (2). Khi thêm HCl, ban đầu chưa có kết tủa vì:
HCl + KOH → KCl + H2O (3)
X – y x – y (mol)
Khi HCl trung hòa hết KOH dư thì bắt đầu có kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 ↓ + KCl (4)
Vậy để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
Ta có: nHCl = nKOH dư sau phản ứng (2) = x – y = 0,1.1 = 0,1 (mol) (I)
Mặt khác: 39x + 27 y = 10,5 (II)
Từ (1) và (II) => x = 0,2; y = 0,1.
% nK = 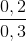 .100% = 66,67%;
.100% = 66,67%;
%nAl = 100% - 66,67% = 33,33%.
K + HOH --> KOH +1/2H2
Al + KOH + HOH --> KAlO2 +3/2H2
-Cho HCl vào bd kg có ket tua => KOH du
HCl + KOH --> KCl + HOH
-Sau đó có ket tua => KOH het => KAlO2 phan ung
KAlO2 + HCl + HOH --> Al(OH)3 + KCl
vì den 100ml dd HCl 1M co xuat hien ket tua nen => n(KAlO2) =n(HCl) = 0,1
=> n(Al) = 0,1
=> %Al = 25,71%
=> %K =74,29%
Luu y: hoi hóa xem bai giai co dung hay co van de nao kg gop ý dum nha thanks

a) Nhiệt lượng cần để để đun nóng 100 lít nước từ 20oC lên 100oC
[4,18x(100 – 20).105 = 334.105 (J) = 334.102 KJ.
Gọi số mol khí thiên nhiên là x mol.
Vậy: số mol CH4 là 0,85x mol; số mol C2H6 là 0,1x mol.
Do đó: 0,85x mol CH4 tỏa ra nhiệt lượng là: 880 x 0,85x = 748 (kJ).
0,1x mol C2H6 tỏa ra nhiệt lượng là 1560 x 0,10x = 156x (kJ).
Ta có: 748x + 156x = 334x102 => x = 36,9 mol.
Vậy, thể tích khí thiên nhiên cần dùng để đun nóng 100 lít nước từ 20oC lên 100oC là 22,4x = 827 lít.
b) 827 lít khí thiên nhiên có 0,85x mol CH4 và 0,1x mol C2H6
106 lít khí thiên nhiên có a mol CH4 và b mol C2H6.
a = = 3,79x104 (mol) CH4
b = = 4,46.103 (mol) C2H6.
2C2H4 → C2H2 → C2H3Cl
2 mol 1mol
3,79.104 mol 1,9.104 mol
C2H6 → C2H2 → C2H3Cl
1 mol 1 mol
4,46.103 mol 4,46.103 mol
Số mol C2H3Cl thực tế thu được:
(1,9.104 + 4,46.103)x0,65 = 1,52.104 (mol)
Khối lượng C2H3Cl thực tế thu được:
1,52.104 x 62,5 = 95.104 (g) = 950 kg.
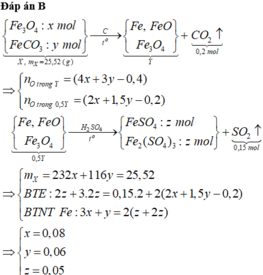
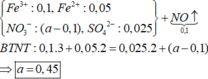
a) Gọi thành phần của Bromobenzen là x1, thành phần của Clorobenzen là x2
Hai cấu tử này tạo với nhau một dung dịch xem như lý tưởng
=> P=P1+P2=P1o.x1+P2o.x2 Mà x1+x2=1 nên P=P1o.x1+P2o.x2= P2o+ (P1o - P2o).x1
=> x1= \(\frac{P-P_2^o}{P_1^o-P_2^o}=\frac{760-762}{400-762}=0,00552\)
=> x2= 1-x1=1-0,00552=0,9948
Vậy thành phần của Bromobenzen là 0,0052, thành phần của Clorobenzen là 0,9948
b) Thành phần của clorobenzen là 10% suy ra thành phần của bromobenzen là 90%
=> tỉ số mol của clorobenzen và bromobenzen trong pha hơi là:
\(\frac{x^h_2}{x^h_1}=\frac{P_2}{P_1}=\frac{P_2^o.x_2^o}{P_1^o.x_1^o}=\frac{760.0,1}{400.0,9}=0,21\)
a, Gọi nồng độ mol riêng phần trong dung dich của (1) là x => nồng độ mol riêng phần của (2) là 1-x. Theo phương trình Raun kết hợp với đề bài, ta có hệ:
Giải hệ phương trình trên ta có P(1)=2.2mmHg, x=5,5.10-3.
Vậy nồng độ phần mol của bromobenzen là 5,5.10-3, của clorobenzen là 1- 5,5.10-3=0,9945
b,Theo phương trình Konovalop I ta có:\(\frac{Y_{\left(1\right)}}{Y_{\left(2\right)}}=\frac{P_{0\left(1\right)}}{P_{0\left(2\right)}}.\frac{x}{1-x}=\frac{400}{762}.\frac{90}{10}=4,7\)
mà Y(1)+Y(2)=1
Vậy Y(1)=0,82, Y(2)=1-0,82=0,18