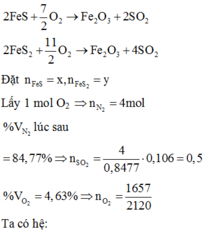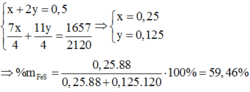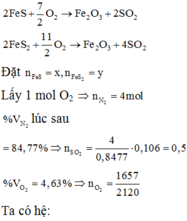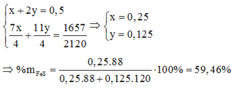Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
N 2 : 0 , 848 m o l S O 2 : 0 , 14 m o l O 2 d u : 1 − 0 , 848 − 0 , 14 = 0 , 012 m o l → K h ô n g k h í N 2 : 0 , 848 m o l O 2 : 0 , 212 m o l
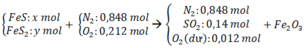
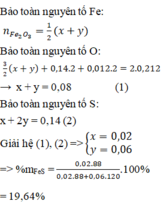

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

Mình chỉ biết phương trình phản ứng thôi ( thông cảm nha )
Phương trình phản ứng :
2FeS2 + 15Br2 + 38OH- \(\rightarrow\) 2Fe(OH)3 + 4SO2-4 + 30Br- + 16H2O (1)
2FeS + 9Br2 + 22OH- \(\rightarrow\) 2Fe(OH)3 + 2SO2-4 + 18Br- + 8H2O (2)
2Fe(OH)3 \(\rightarrow\) Fe2O3 + 3H2O (3)
Ba2+ SO-24 \(\rightarrow\) BaSO4 (4)
Bạn phía kia viết pt r nên mk k viết nữa
Gọi: nFeS2=a
nFeS=b
nFe2O3=0,2/160=1.25.10^(-3)
nBaSO4~4,76.10^(-3)
Ta có hệ:
\(\left\{{}\begin{matrix}a+b=2.1,25.10^{-3}\left(BtFe\right)\\2a+b=4,76.10^{-3}\left(BtS\right)\end{matrix}\right.\)
=>a,b
Số hơi kinh khủng nên mừn hăm viết ra đâu ạ =)))

Gọi a, b , c lần lượt là số mol của FeS2, Cu2S, Ag2S
\(PTHH:4FeS_2+11O_2\rightarrow2Fe_{ }2O_3+8SO_2\)
___________a________________0,5a_______2a
\(CuS_2+2O_2\rightarrow2CuO+SO_2\)
b ______________2b______ b
\(Ag_2S+O_2\rightarrow2Ag+SO_2\)
c ____________________c
\(2SO_2+O_2\rightarrow2SO_3\)
(2a+b+c)_________(2a+b+c)
\(SO_3+H_2O\rightarrow H_2SO_4\)____ddG là ddH2SO4
(2a+b+c)_______ (2a+b+c)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
2b ______2b______________2b
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,5a ______1,5a __________ 0,5a _______________
Vì phản ứng xảy ra vừa đủ nên \(2b+1,5a=2a+b+c\) hay \(0,5a-b+c=0\left(1\right)\)
\(Ba\left(OH\right)_2+CuSO_4\rightarrow BaSO_4\downarrow+Cu\left(OH\right)_2\downarrow\)
__________2b __________2b________2b
\(3Ba\left(OH\right)_2+Fe_2\left(SO_4\right)_3\rightarrow3BaSO_4\downarrow+2Fe\left(OH\right)_3\downarrow\)
_______________0,5a _______1,5a ____________ a
\(m_{\downarrow}=233.2b+98.2b+232.1,5a+107a=562,2a+455b=166,55\left(2\right)\)
\(m_E=120a+160b+248c=60,8\left(3\right)\)
\(\left(1\right)+\left(2\right)+\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,174\\b=0,15\\c=0,064\end{matrix}\right.\)
\(m_{FeS2}=0,174.120=20,9\left(g\right)\)
\(m_{CuS2}=0,15.160=24\left(g\right)\)
\(m_{AgS2}=248.0,064=15,9\left(g\right)\)