Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{CO_2}=\dfrac{3,36}{22,4}.44=6,6(g)\)
Áp dụng định luật BTKL: \(m_{\text{hh muối}}=m_{\text{hh oxit}}+m_{CO_2}=76+6,6=82,6(g)\)

\(a) n_{Mg} = a(mol) ; n_{Fe} = b(mol)\\ \Rightarrow 24a + 56b = 9,6(1)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ n_{O_2} = 0,5a + \dfrac{2}{3}b = \dfrac{2,8}{22,4} = 0,125(2)\\ (1)(2)\Rightarrow a = 0,05 ; b = 0,15\\ m_{Mg} = 0,05.24 = 1,2(gam) ; m_{Fe} = 0,15.56 = 8,4(gam)\\ b) m_{oxit} = m_A + m_{O_2} = 9,6 + 0,125.32 = 13,6(gam)\)

Gọi:
M là NTK của R
a là số oxi hóa của R trong muối --> CTPT muối của R là R(2/a)CO3.
a/
Từ nCO2 = n hỗn hợp = 0,5 nHCl = 3,36/22,4 = 0,15
--> nHCl = 0,15 x 2 = 0,3 mol nặng 0,3 x 36,5 = 10,95 gam.
--> dung dịch axit HCl 7,3% nặng 10,95/0,073 = 150 gam.
Mà m dung dịch sau phản ứng = m dung dịch axit + m C - m CO2 bay ra
= 150 + 14,2 - (0,15 x 44) = 157,6 gam
--> m MgCl2 = 0,06028 x 157,6 = 9,5 gam
--> n MgCl2 = 9,5/95 = 0,1 mol = n MgCO3
--> m MgCO3 = 0,1 x 84 = 8,4 gam chiếm 8,4/14,2 = 59,154929%
--> m R(2/a)CO3 = 14,2 - 8,4 = 5,8 gam chiếm 5,8/14,2 = 40,845071%
--> n R(2/a)CO3 = 0,15 - 0,1 = 0,05 mol.
--> PTK của R(2/a)CO3 = 5,8/0,05 = 116.
--> 2M/a = 116 - 60 = 56 hay M = 23a.
Chọn a = 2 với M = 56 --> R là Fe.
b/
Khối lượng chất rắn sau khi nung đến khối lượng không đổi là khối lượng của 0,1 mol MgO và 0,05 mol FeO(1,5). (FeO(1,5) là cách viết khác của Fe2O3. Cũng là oxit sắt 3 nhưng PTK chỉ bằng 80).
m chất rắn sau khi nung = (0,1 x 40) + (0,05 x 80) = 8 gam.
m = 84a + (Rx + 60y)b = 14,2 g
nCO2 = a + by = \(\frac{3,36}{22,4}\) = 0,15
nHCl = 2nCO2 = 0,3
mHCl = 0,3.36,5 = 10,95 g
mdd = \(\frac{10,95.100}{7,3}\) = 150 g
Khối lượng dd sau phản ứng: 150 + 14,2 - 0,15.44 = 157,6 g
nMgCl2 = a \(\frac{157,6.6,028}{100.95}=0,1\)
Thay a vào trên ta được:
Rbx + 60by = 5,8
mà by = 0,05 [/COLOR]
=> b = \(\frac{0,05}{y}\)
=> Rx/y = 56
x = y = 1 và R = 56 => Fe
nMgCO3 = 0,1 mol và nFeCO3 = 0,05
=> %
b. nMgO = nMgCO3 = 0,1
nFe2O3 = nFeCO3/2 = 0,025
m = 0,1.40 + 0,025.160 = 8 g

\(a.MgCO_3-t^{^0}->MgO+CO_2\\ CaCO_3-t^{^0}->CaO+CO_2\\ b.n_{MgCO_3}=a,n_{CaCO_3}=b\\ 84a+100b=26,8\\ 40a+56b=13,6\\ a=0,2;b=0,1\\ \%m_{MgCO_3}=\dfrac{84a}{26,8}.100\%=62,69\%\\ \%m_{CaCO_3}=37,31\%\\ c.V_{CO_2}=22,4\left(a+b\right)=6,72L\)

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
- Nếu Zn tan hết
PTHH: 2Na + 2H2O --> 2NaOH + H2
______a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
__2b<----b-------------------->b
=> \(\left\{{}\begin{matrix}2b\le a\\0,5a+b=14,3\end{matrix}\right.\) => Loại
=> Zn không tan hết => NaOH hết
PTHH: 2Na + 2H2O --> 2NaOH + H2
______a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
_a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
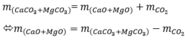

Gọi số mol CaCO3;MgCO3 lần lượt là : a;b
PTHH:
CaCO3 -->(nhiệt độ) CaO+CO2 (1)
P/ứ: a -------------------> a ---> a (mol)
MgCO3-->(nhiệt độ) MgO+CO2 (2)
P/ứ: b--------------------> b ---> b Mol)
Theo PTHH (1);(2) => mCaO+mMgO
=56a+40b=76(g) (*1)
và nCO2=a+b=33.6/22.4=1.5(mol) (*2)
Kết hợp (*1) và (*2) => a=1;b=0.5
=>mCaCO3=1*100=100(g)
mMgCO3=0.5*84=42(g)
=>%mCaCO3=100/(100+42)*100%
=70.42%
%mMgCO3=100%-76.42%=23.58%