Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

9
nSO2 = 4,48 : 22,4 = 0,2 (mol) ; nNaOH = 16: 40 = 0,4 (mol)
Ta thấy nNaOH/ nSO2 = 2 => chỉ tạo muối Na2SO3
=> mNa2SO3 = 0,2. 126 = 25, 2(g) =>D
10
nBa(OH) = 0,15.1 = 0,15mol; nBaCO3 = 19,7 : 197 = 0,1mol
Vì nBaCO3 < nBa(OH)2 → xét 2 trường hợp
Trường hợp 1: Ba(OH)2 dư, CO2 hết, phản ứng chỉ tạo muối cacbonat
CO2 + Ba(OH)2 → BaCO3 + H2O
0,1 0,1
Vậy V = VCO2 = 0,1.22,4 =2,24
Trường hợp 2: Phản ứng sinh ra 2 muối cacbonat và hiđrocacbonat
CO2 + Ba(OH)2→ BaCO3 + H2O (1)
0,1 0,1 0,1
2CO2+Ba(OH)2→Ba(HCO3)2
0,1 0,05
Theo phương trình (1): nBa(OH)2(1) = nBaCO3=0,1mol
Mà nBa(OH)2= 0,15mol →nBa(OH)2 (2) = 0,15−0,1 = 0,05mol
Theo (1) và (2): nCO2 = nBaCO3 + 2nBa(OH)2 (2) = 0,1 + 2.0,05 = 0,2 mol
Vậy V = VCO2 = 0,2.22,4 = 4,48 lít
=>A

a/ Số mol của HCl = 0,425 x 2 = 0,85mol
Gọi x, y lần lượt là số mol của Al, Mg trong hỗn hợp
Giả sử kim loại phản ứng hết
2Al + 6HCl ===> 2AlCl3 + 3H2
x...........3x...............................1,5x
Mg + 2HCl ===> MgCl2 + H2
y..........2y...............................y
Lập các sô mol trên phương trình, ta có
27x + 24y = 7,5 <=> 27x + 18y < 7,5
<=> (3x + 2y ) x 9 < 7,5 => 3x + 2y < 0,833 (mol) < 0,85
Vì số mol HCl phản ứng bé hơn số mol HCl đầu, nên HCl dư
b/ Chuyển m (gam) CuO thành (m - 5,6) gam chất rắn => Giảm 5,6 gam
Vậy nCuO(pứ) = nO(bị khử) = 5,6 / 16 = 0,35 mol
H2 + CuO =(nhiệt)==> Cu + H2O
0,35...0,35(mol)
Ta có: \(\begin{cases}27x+24y=7,5\\1,5x+y=0,35\end{cases}\)
=> \(\begin{cases}x=0,1\\y=0,2\end{cases}\)
=> mAl = 0,1 x 27 = 2,7 gam
mMg = 7,5 - 2,7 = 4,8 gam

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

m C O 2 = m m u o i - m r a n = 14,2 - 7,6 = 6,6g
⇒ n C O 2 = 6,6/44 = 0,15mol
n K O H : n C O 2 = 0,1:0,15 < 1
Vậy chỉ tạo muối K H C O 3 .
⇒ n K H C O 3 = n K O H = 0,1 mol
⇒ m K H C O 3 = 0,1.100 = 10g
⇒ Chọn D.

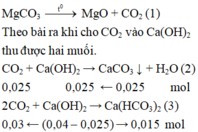
C a H C O 3 2 + 2 N a O H d ư → C a C O 3 ↓ + N a 2 C O 3 + 2 H 2 O ( 4 ) 0 , 015 → 0 , 015 m o l
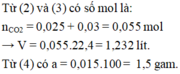
Đáp án A

nCaCO3=50/100=0,5(mol)
nNaOH=2.0,15=0,3(mol)
PTHH: CaCO3 -to-> CaO + CO2
0,5_____________0,5__0,5(mol)
Ta có: nNaOH/nCO2=0,3/0,5=0,6<1
=>Sp thu được duy nhất muối NaHCO3, có dư CO2.
PTHH: CO2 + NaOH -> NaHCO3
0,3_________0,3_______0,3(mol)
=> m(muối)=mNaHCO3=84.0,3= 25,2(g)
=> CHỌN A
nCaCO3 = 0,5 mol ; nNaOH = 0,3 mol
CaCO3 ➜ CaO + CO2
0,5 -----------------> 0,5
Tỉ lệ: T= nNaOH / nCO2 = \(\dfrac{3}{5}\) < 1
➩ Tạo ra 1 muối là NaHCO3 và CO2 dư
PTHH:
CO2 + NaOH ➜ NaHCO3
0,5 0,3 ------> 0,3
nNaHCO3 = 0,3 mol ➜ mNaHCO3 = 25,2 (g) ➜ A