Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+) Một loại đá vôi chứa 80% CaCO3
nung m gam đá vôi => chất rắn 0,78m (gam)
+) m gam đá vôi chứa 0,8m gam CaCO3
\(n_{CaCO_3pư}=\dfrac{m-0,78m}{22}=0,005m\left(mol\right)\)
=> \(m_{CaCO_3pư}=0,005m\cdot100=0,5m\left(gam\right)\)
=> H=0,5m : 0,8m =62,5%
Vậy...

b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

1)
đặt nCaCO3pứ=a(mol) đk a>0)
nCaCO3=200/100=2(mol)
CaCO3 -to-> CaO+CO2
a ------------> a-----> a (mol)
nCaCO3dư=2-a(mol)
mCR=mCaCO3 dư + mCaO=100(2-a)+56a=156(g)
=> a=1
Hiệu suất phản ứng =\(\frac{n_{CaCO3}pứ}{n_{CaCO3}bđ}.100\%=\frac{1}{2}.100\%=50\%\)

CaCO3 ---> CaO + CO2
Có : 0,2
P/ứ: x x
Còn : 0,2 - x
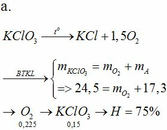
nCaCO3 = \(\dfrac{20}{100}=0,2\left(mol\right)\)
Ta có :
(0,2-x) . 100 + 56x = 13,4
=> x = 0,15
=> H = \(\dfrac{0,15}{0,2}=75\%\)

Kudo làm sai , anh làm lại nha!
\(a,n_{BaCO_3}=\dfrac{49,25}{197}=0,25\left(mol\right)\\ PTHH:BaCO_3\rightarrow\left(t^o\right)BaO+CO_2\\ n_{CO_2\left(LT\right)}=n_{BaO\left(LT\right)}=n_{BaCO_3}=0,25\left(mol\right)\\ \Rightarrow n_{BaO\left(TT\right)}=n_{CO_2\left(TT\right)}=0,6.0,25=0,15\left(mol\right)\\ V_{CO_2\left(TT,đktc\right)}=0,15.22,4=3,36\left(l\right)\\ b,BaCO_3\rightarrow\left(t^o\right)BaO+CO_2\\ n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow n_{BaCO_3\left(LT\right)}=n_{CO_2}=0,15\left(mol\right)\\ \Rightarrow n_{BaCO_3\left(TT\right)}=\dfrac{0,15}{80\%}=0,1875\left(mol\right)\\ m_{BaCO_3\left(TT\right)}=a=0,1875.197=\dfrac{591}{16}\left(g\right)\\ c,n_{BaCO_3}=\dfrac{49,25}{197}=0,25\left(mol\right)\)
\(Đặt:n_{BaCO_3\left(tg\right)}=j\left(mol\right)\left(a>0\right) \\Mà:m_{rắn}=42,65\\ \Leftrightarrow137j+\left(49,25-197j\right)=42,65\\ \Leftrightarrow j=11\%\\ \Rightarrow H=\dfrac{j}{0,25}.100\%=\dfrac{0,11}{0,25}.100=44\%\)


CaCO3 -->CaO +CO2
nCaCO3=12/100=0,12(mol)
nCaO=7,6/56=0,135(mol)
theo PTHH : nCaO=nCaCO3=0,12(mol)
=>H=\(\dfrac{0,12}{0,135}.100=88,89\left(\%\right)\)