Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
n FeSO 4 dư = 0,0075.0,015 = 1,125. 10 - 4 mol
25 ml FeSO4 tương đương với 35 ml dung dịch chuẩn K2Cr2O7
=> n K 2 Cr 2 O 7 phản ứng = 35 - 7 , 5 1000 . 0 , 015 = 4 , 125 . 10 - 4 mol
⇒ n Cr ( quặng ) = 2 n K 2 Cr 2 O 7 phải ứng . 100 20 = 4 , 125 . 10 - 3 mol
⇒ % m Cr ( quặng ) = 52 . 4 , 125 . 10 - 3 1 . 100 % = 21 , 45 %

Mình ko phải giáo viên đâu!!!!
Đối với những bài có quá nhiều chất cậu nên quy ước về các nguyên tố rồi áp dụng bảo toàn e là đơn giản nhất!!!![]()
Bài giải:
Fe \(\rightarrow\) Fe+3 + 3e 4H+ + NO3- + 3e => NO +2 H2O
Gọi n Fe= a mol ta có: nNO => nH+ (trong ax) =>nH+ =0,12+0,05 = 0,17 mol
dễ nhận thấy: nH+ (dư) + 3nFe = nNaOH => (0,17-4a) + 3a = 0,13 => a=0,04 mol
=> dd Y có : 0,04 mol Fe3+ và 0,01 mol H+ (dư)
khi cho Cu vào Y thì có các PƯ sau:
Fe3+ + 1e => Fe2+ ; Cu => Cu2+ + 2e ; 4H+ + NO3- + 3e => NO + 2 H2O
áp dụng định luật bảo toàn e ta có: 0,04 + \(\frac{3}{4}\) 0,01 = 0,0475 mol (e nhường) => nCu=0,02375 mol
Vậy m Cu=0,02375.64= 1,52 (g)
bài này nhiều chỗ mình trình bày chưa chặt chẽ mong các bạn và thầy cô đóng góp ý kiến!!!!!!!

\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,1.1=0,1\left(mol\right)\)
PTHH :
\(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
trc p/u : 0,1 0,1
p/u : 0,1 0,05 0,05 0,1
sau p/u : 0 0,05 0,05 0,1
\(C_{M_{BaCl_2}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
\(C_{M_{Ba\left(OH\right)_2dư}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
\(m_{BaCl_2}=0,05.208=10,4\left(g\right)\)

Fe được hòa tan hoàn toàn bởi dd HNO3 thu được dd X, khi thêm HCl vào X có khí NO thoát ra → trong X có ion Fe2+ → HNO3 đã phản ứng hết
n(NO) = \(\frac{0,672}{22,4}\) = 0,03mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 4H2O
0,03___0,12____________0,03
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
x___________________3x
Theo ĐL bảo toàn nguyên tố, số mol NO3- có trong muối:
n(NO3- trong muối) = n(HNO3) - n(NO) = 0,09mol
n(NaOH) = 0,1.1,3 =0,13mol
Sau khi NaOH pư hoàn toàn với các chất trong dd Y, dung dịch thu được có:
n(Na+) = n(NaOH) = 0,13mol; n(Cl-) = n(HCl) = 0,05mol
→ n(NO3-) = n(Na+) - n(Cl-) = 0,13 - 0,05 = 0,08mol
→ Số mol NO3- bị Fe2+ khử: 0,09 - 0,08 = 0,01mol
NO3- + 3Fe2+ + 4H+ → 3Fe3+ + NO + 2H2O
0,01___0,03____0,04
NO3- và H+ đều dư (H+ dư 0,01mol) → Fe2+ đã phản ứng hết → 3x = 0,03 → x = 0,01mol
Tổng số mol Fe: n(Fe) = 0,03 + x = 0,04mol
Khối lượng Fe đã sử dụng: m(Fe) = 0,04.56 = 2,24g

Đáp án B
Có khối lượng chất rắn sau khi nung < mX
=> Chứng tỏ X phản ứng còn dư, Cu(NO3)2 phản ứng hết.
· Trường hợp 1: Mg phản ứng còn dư.
Áp dụng tăng giảm khối lượng có:
nMg phản ứng 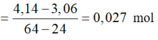
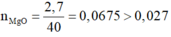 => Vô lý
=> Vô lý
· Trường hợp 2: Fe đã tham gia phản ứng.
Đặt số mol Mg và Fe phản ứng lần lượt là a, b.
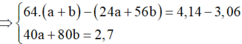
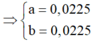
![]()
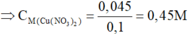
Nồng độ đương lượng của một dung dịch được định nghĩa là số đương lượng gam chất tan có trong 1 lít dung dịch. Đương lượng của một chất phụ thuộc vào số mol của chất đó và khả năng tham gia vào phản ứng hóa học (thường liên quan đến số ion H⁺ hoặc OH⁻, hoặc các electron mà chất đó có thể cho hoặc nhận).
Vì vậy, đáp án đúng là:
B. Số đương lượng gam chất tan trong 100ml dung dịch.
Lý do là "số đương lượng gam" chính là đơn vị dùng để đo lường nồng độ đương lượng của dung dịch.