Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 6. Hãy sắp xếp các nguyên tố sau theo chiều tính phi kim tăng dần : F, O, N, P, As.
Giải thích.
Lời giải:
Vị trí các nguyên tố trên trong bảng tuần hoàn:
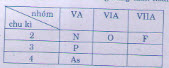
Theo chu kì 2, tính phi kim tăng dần từ N, O, F.Theo nhóm VA, tính phi kim tăng dần từ As, P, N.
Vậy: Tính phi kim tăng dần từ trái sang phải là As, P, N, O, F.
Vị trí các nguyên tố trên trong bảng tuần hoàn:

Theo chu kì 2, tính phi kim tăng dần từ N, O, F.Theo nhóm VA, tính phi kim tăng dần từ As, P, N.
Vậy: Tính phi kim tăng dần từ trái sang phải là As, P, N, O, F.

Theo bảng phân loại tuần hoàn, trong một chu kì từ trái sang phải bán kính nguyên tử giảm dần nên khả năng dễ mất electron lớp ngoài cùng giảm dần nên tính kim loại giảm, khả năng nhận thêm electron ở lớp ngoài cùng tăng dần nên tính phi kim tăng. Trong cùng một phân nhóm, từ trên xuống dưới bán kính tăng dần (giải thích tương tự cho tính kim loại và tính phi kim)
1.N và O cùng chu kì 2, từ trái sang phải tính phi kim tăng nên tính phi kim: N < O (1)
N và P cùng nhóm VA, từ trên xuống dưới tính phi kim giảm nên tính phi kim : N > P (2)
Từ (1) và (2) => Tính phi kim tăng dần: P < N < O
2. Chọn A và C

Bổ sung cho Dương nha:
- Tính kim loại giảm dần: K > Mg > Al > P > O > F
- Tính phi kim tăng dần: K < Mg < Al < P < O < F

Câu 1: Cho luồng khí H22 (dư) qua hỗn hợp các oxit CuO, Fe22O33, ZnO, MgO nung ở nhiệt độ cao. Sau khi các phản ứng xảy ra hoàn toàn, hỗn hợp chất rắn còn lại là
A. Cu, FeO, ZnO, MgO
B. Cu, Fe, Zn, MgO
C. Cu, Fe, ZnO, MgO
D. Cu, Fe, Zn, Mg
Câu 2: Dãy gồm các chất đều phản ứng với nước là:
A. Fe2O3, CO2, N2O
B. Al2O3, BaO, SiO2
C. CO2, N2O5, BaO
D. CO2, CO, BaO
Câu 3: Dãy gồm các chất đều được với dung dịch NaOH là:
A. N2O5, CO2, Al2O3
B. Fe2O3, Al2O3, CO2
C. CO3, N2O5, CO
D. N22O55, BaO, CuO
Câu 4: Dãy gồm các chất đều phản ứng với dung dịch HCl tạo thành sản phẩm có chất khí là
A. NaOH, Al, Zn
B. Fe(OH)22, Fe, MgCO33
C. CaCO33, Al22O33, K22SO33
D. BaCO3, Mg, K2SO3
Câu 5: Dãy chất nào sau đây có thể cùng tồn tại trong một dung dịch?
A. NaCl, CuSO4, AgNO3
B. CuSO4, MgCl2, KNO3
C. AgNO3, KNO3, NaCl
D. KNO3 BaCl2, Na2CO3
Câu 6: Phát biểu nào sau đây là đúng?
A. Các phi kim thường dẫn điện, dẫn nhiệt tốt
B. Các phi kim chỉ tồn tại ở trạng thái rắn và trạng thái khí
C. Các phi kim thường có nhiệt độ nóng chảy thấp
D.Các phi kim đều ít tan trong nước, đều rất độc
Câu 7: Có ba chất cacbon oxit,hidro clorua, clo đựng trong ba bình riêng biệt. CHỉ dùng thuốc thử nào sau đây có thể nhận biết được ba bình khí nói trên?
A. dd NaOH B. dd phenolphtalein C. giấy quỳ tím ẩm D. Đồng (II) oxit
Câu 8: Vật dụng nào sau đây không nên dùng để đựng vôi vữa?
A. chậu nhựa B. chậu nhôm C. chậu đồng D. chậu sắt tây
Câu 9: Phát biểu nào sau đây không đúng?
A. Nhiều phi kim tác dụng với oxit tạo thành oxit axit
B. Các phi kim tác dụng với hiđro đều tạo thành hợp chất khí
C. Các phi kim tác dụng với kim loại đều tạo thành muối
D. Phần lớn các phi kim không dẫn nhiệt, không dẫn điện
Câu 10: Phát biểu nào sau đây đúng?
A. Trong một chu kì, đi từ đầu chu kì tới cuối chu kì theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
B. Số thứ tự của một nguyên tố trong bảng tuần hoàn luôn bằng số đơn vị điện tích hạt nhân, bằng số proton, bằng số electron và bằng số nơtron trong nguyên tử của nguyên tố
C. Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau
D. Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần nguyên tử khối

4 nguyên tố này là phi kim nên sẽ so sánh tính phi kim của chúng.
Tính phi kim giảm dần: F > O > Cl > N
(E kiểm tra lại đề xem thế nào nhé? Không có tính "phi kim loại")

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
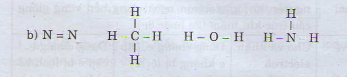
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

Sắp xếp các nguyên tố theo chiều tính phi kim giảm dần có nghĩa là sắp xếp theo mức độ hoá trị tăng dần. Với sự tăng dần của hoá trị, chất trở nên phân cực mạnh hơn và tính phi kim tăng lên.
Theo đó, chúng ta có thể sắp xếp các nguyên tố theo chiều tính phi kim giảm dần như sau:
1. F (hoá trị -1): Fluor có hoá trị -1, tức là có khả năng nhường điện tử cho các nguyên tố khác mạnh hơn.
2. O (hoá trị -2): Oxygen có hoá trị -2, tương tự như Fluor, có khả năng nhường điện tử tốt hơn nên là một nguyên tố phi kim mạnh.
3. N (hoá trị -3): Nitrogen có hoá trị -3, vì vậy cũng có tính phi kim cao.
4. As (hoá trị +3, +5): Arsenic có thể có hoá trị +3 hoặc +5, tuy nhiên, ở dạng As3+, hoá trị tăng và chất trở nên phân cực hơn, vì vậy As3+ có tính phi kim cao hơn nhiều so với As5+. Do đó, chúng ta sẽ đặt As vào vị trí cuối cùng trong danh sách.
5. P (hoá trị +3, +5): Phosphorus cũng có thể có hoá trị +3 hoặc +5. Mặc dù cả hai hoá trị đều là phi kim, nhưng với hoá trị +3, chất có tính phi kim cao hơn, vì vậy sẽ đặt P3+ trước As3+.
Vậy kết quả sau khi sắp xếp theo chiều tính phi kim giảm dần là: F, O, N, P, As.
- Trong một chu kỳ, điện tích hạt nhân tăng thì tính phi kim tăng.
→ F > O > N
- Trong một nhóm, điện tích hạt nhân tăng thì tính phi kim giảm.
→ N > P > As
⇒ F > O > N > P > As
Đáp án: D
Các nguyên tố C, N, O, F cùng thuộc chu kỳ 2; Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân tính phi kim của các nguyên tố tăng dần → Tính phi kim: C < N < O < F