Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C.
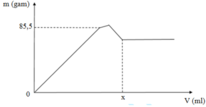
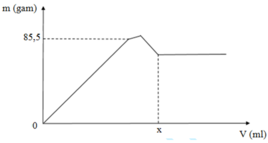
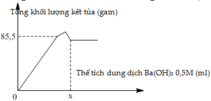
Khi mkết tủa = 85,5 gam, Al2(SO4)3 vừa phản ứng hết, K2SO4 bắt đầu phản ứng.
Đặt n A l 2 S O 4 3 = a mol
⇒ m B a S O 4 + m A l O H 3 = 85 , 5 g
⇒ 233 . 3 a + 78 . 2 a = 85 , 5
⇒ a = 0 , 1 mol
· Khi V d d B a O H 2 = x ml, kết tủa Al(OH)3 tan hết, chỉ còn kết tủa BaSO4
![]()

Đáp án C
Giai đoạn 1: Tạo đến 85,5 gam kết tủa là Ba(OH)2 chơi với (a mol) Al2(SO4)3
→ Al(OH)3 : 2a ;BaSO4 → a=0,1:3a . Tại x lượng kết tủa không đổi < 85,5
→ Lượng Al(OH)3 tan nhiều hơn lượng BaSO4 sinh ra từ K2SO4.
Tại x→∑Ba(OH)2 = 0,3+0,1 = 0,4 →x = 800

Đáp án B
Đồ thị trải qua các giai đoạn :
+Kết tủa tăng nhanh do tạo đồng thời 2 kết tủa Al(OH)3và BaSO4.
+Kết tủa tăng chậm lại do tạo kết tủa BaSO4 đồng thời hòa tan Al(OH)3.
+Kết tủa giảm dần tới không đổi, lúc này hòa tan Al(OH)3.
Gọi số mol Al2(SO4)3 là a
![]()
Só mol OH- cần để tạo và hòa tan Al(OH)3 là 0,1.2.4=0,8 mol
![]()

Chọn C.
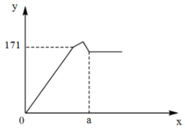
Đặt x, y lần lượt là số mol của Al2(SO4)3, K2SO4.
Tại y = 171 (g)
Þ 2x.78 + 3x.233 = 171
Þ x = 0,2.
Vậy a = 4.x = 0,8

Đáp án A
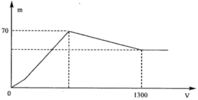
Quan sát nhanh: đoạn OAB có điểm gấp khúc tại A →cho biết X gồm Ba(AlO2)2 và Ba(OH)2
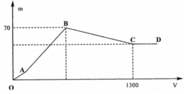
Đoạn OA biểu diễn tỉ lệ phản ứng: H2SO4 + Ba(OH)2 BaSO4 + 2H2O
Đoạn AB biểu diễn tỉ lệ phản ứng: H2SO4 + Ba(AlO2)2 + 2H2O BaSO4 + 2Al(OH)3
(Ngoài lượng kết tủa BaSO4 còn có Al(OH)3 nên mới tạo gấp khúc từ O đến B như hình).
Đoạn BC biểu diễn quá trình hòa tan: 3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
Đến điểm C, kết tủa Al(OH)3 tan vừa hết, chỉ còn kết tủa BaSO4 không đổi khi them H2SO4 (đoạn CD).
Gọi số mol các chất trong X: x mok Ba(AlO2)2 và y mol Ba(OH)2. Dựa vào giả thiết đồ thị, phân tích:
Tại điểm B, kết tủa cực đại 70 gam gồm (x + y) mol BaSO4 và 2x mol Al(OH)3
phương trình :
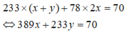
Tại điểm C, tương ứng 0,65 mol H2SO4 phản ứng ⇌ 0,65 mol gốc SO4 cuối cùng đi về đâu?
trong a mol Al2(SO4)3 và (x+y) mol BaSO4 ![]() (2)
(2)
Theo đó, giải hệ các phương trình (1) và (2) được x=0,15 mol và y=0,15 mol
![]()

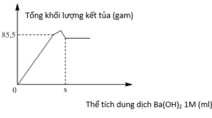



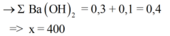
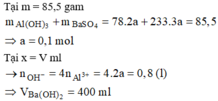
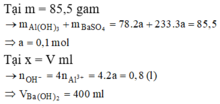


Chọn đáp án D.
Giai đoạn 1: Tạo đến 85,5 gam kết tủa là Ba(OH)2 chơi với (a mol) Al2(SO4)3
85 , 5 A l ( O H ) 3 : 2 a B a S O 4 : 3 a ⇒ a = 0 , 1
Tại x lượng kết tủa không đổi < 85,5 → Lượng Al(OH)3 tan nhiều hơn lượng BaSO4 sinh ra từ K2SO4.
Tại x ∑ B a ( O H ) 2 = 0 , 3 + 0 , 1 = 0 , 4 ⇒ x = 400