Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe2O3= 24/160= 0,15(mol)
PTHH: 2 Fe(OH)3 -to-> Fe2O3 +3 H2O
nFe(OH)3= 2. 0,15=0,3(mol)
=>x=mFe(OH)3= 107.0,3= 32,1(g)
=>x=32,1(g)

nMg= 0.09 mol
nNO= 0.04 mol
Mg----> Mg2+ + 2e
0.09 ----------------------------0.18
N+5 + 3e-----------.> N+2
0.12<--------0.04
vi số mol e nhận < số mol e nhường----> sản phâm muối còn có NH4NO3
gọi x là số mol của NH4NO3
N+5 +8e-----------> N-3
8x<------------x
Theo bao toàn e ta có: 8x + 0.12= 0.18 +> x= 0.0075
==> m NH4No3 = 0.0075 x 80=.........
m Mg(NO3)2= 0.09 x 148=......
khối luọng muói tạo thành = m Mg(NO3)2 + m NH4No3 =......
n NaOH = 0,03 mol
1)
Trong Z chứa: NaAlO2 + NaOH dư có tổng số mol = 0,03 mol
Z tác dụng vs HCl đến khi xuất hiện kết tủa thì ngừng => phản ứng hết NaOH dư => nNaOH dư = n HCl = 0,01 mol
=> n NaAlO2 = 0,03 -0,01 = 0,02 mol => nAl2O3 = 0,01 mol
2)
+) Phần 1 của Y
nH2SO4 = 0,03 mol = nCuO + nFeO
+) Phần 2 của Y
Hỗn hợp khí thoát ra là CO2 và CO dư
Theo sơ đồ chéo tính được n CO2 = 2nCO và tổng số mol khí = 0,03
=> nCO2 = 0,02 mol
=> m Hỗn hợp oxit ban đầu = 2+ 0,02.16 = 2,32 g
Ta có hệ phương trình:
x+y = 0,03
72x + 80y= 2,32
=> x = 0,01 y =0,02
=> trong hỗn hợp ban đầu: n FeO = 0,02 mol. nCuO = 0,04 mol

a) \(2Fe\left(OH\right)_3-^{t^o}\rightarrow Fe_2O_3+3H_2O\)
\(Cu\left(OH\right)_2-^{t^o}\rightarrow CuO+H_2O\)
Gọi x,y lần lượt là số mol Fe(OH)3 và Cu(OH)2
=> \(\left\{{}\begin{matrix}107x+98y=20,5\\160.\dfrac{x}{2}+80y=16\end{matrix}\right.\)
=> x= 0,1 ; y=0,1
=> \(\%m_{Fe\left(OH\right)_3}=\dfrac{0,1.107}{20,5}.100=52,2\%\)
\(\%m_{Cu\left(OH\right)_2}=47,8\%\)
b) \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
\(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
\(n_{H_2SO_4}=0,1.\dfrac{3}{2}+0,1=0,25\left(mol\right)\)
\(m_{ddH_2SO_4}=\dfrac{0,25.98}{20\%}=122,5\left(g\right)\)
\(m_{ddsaupu}=20,5+122,5=143\left(g\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,05.400}{143}.100=13,97\%\)
\(C\%_{CuSO_4}=\dfrac{0,1.160}{143}.100=11,19\%\)
c) \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{Fe_2O_3}=0,05\left(mol\right);n_{CuO}=0,1\left(mol\right)\)
=> \(n_{H_2SO_4}=0,05.3+0,1=0,25\left(mol\right)\)
\(m_{ddH_2SO_4\left(pứ\right)}=\dfrac{0,25.98}{20\%}=122,5\left(g\right)\)
=> \(m_{ddH_2SO_4\left(bđ\right)}=122,5.110\%=134,75\left(g\right)\)

a) PTHH: \(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)=n_{Cu\left(OH\right)_2}\) \(\Rightarrow m_{Cu\left(OH\right)_2}=0,05\cdot98=4,9\left(g\right)\)
b) PTHH: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\\n_{H_2SO_4}=\dfrac{250\cdot9,8\%}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{CuSO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05\cdot160}{4,9+250}\cdot100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2\cdot98}{4,9+250}\cdot100\%\approx7,7\%\end{matrix}\right.\)
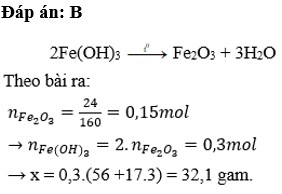

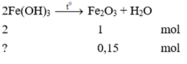
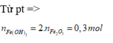
nFe2O3 = 23/160=0.14375mol
2Fe(OH)3 -> Fe2O3 + 2H2O
(mol) 0.2875 0.14375
mFe(OH)3 = x = 0.2875*107=30.7625g
nfe2o3=24/160 chứ bạn