
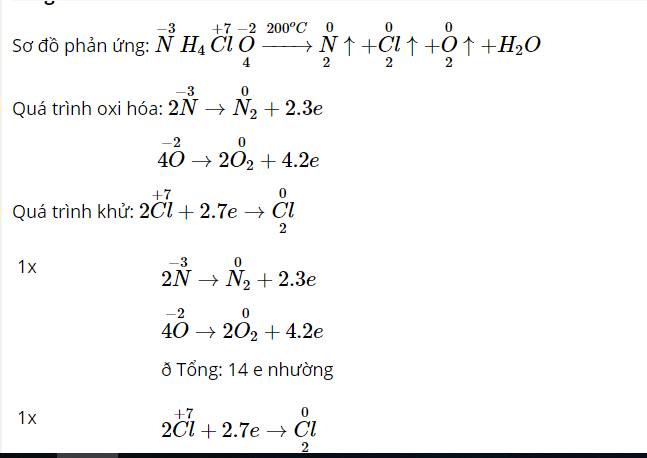
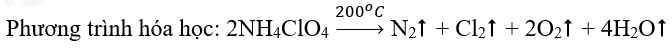
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

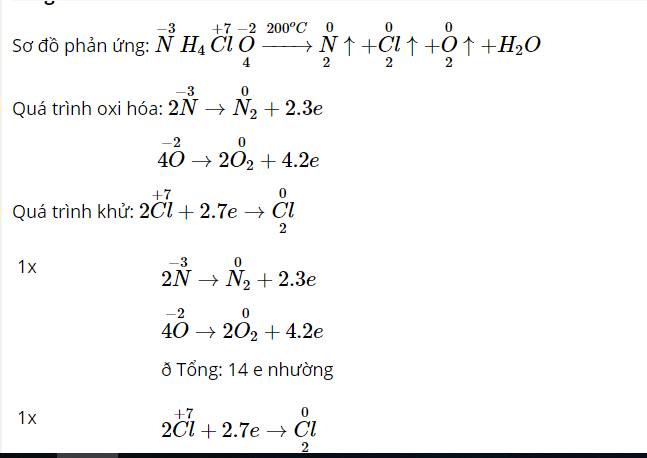
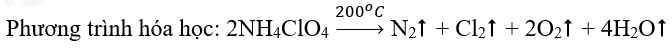

- Cốc (2) ở nhiệt độ thường, các hạt KMnO4, H2C2O4 và H2SO4 chuyển động với tốc độ nhỏ, khả năng va chạm ít => Phản ứng diễn ra chậm => Lâu mất màu
- Cốc (1) ở nhiệt độ cao, các hạt KMnO4, H2C2O4 và H2SO4 chuyển động với tốc độ lớn, khả năng va chạm cao => Phản ứng diễn ra nhanh => Nhanh mất màu

a) Theo thời gian, nồng độ có xu hướng tăng dần
=> Đồ thị mô tả sự thay đổi nồng độ theo thời gian của sản phẩm HCl
b) Đơn vị của tốc độ phản ứng trong trường hợp này là phút (min).

- Khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)
+ Liên kết H-H và O=O bị phá vỡ
+ Liên kết H-O-H được hình thành

1.
- Từ F2 đến I2, tính oxi hóa của các halogen giảm dần
=> Khả năng hoạt động của các đơn chất halogen giảm dần
=> Xu hướng phản ứng với hydrogen giảm dần
2.
- Dựa vào Bảng 12.2 ta nhận thấy: Từ F đến I, năng lượng liên kết của halogen với hydrogen giảm dần
=> Khả năng halogen liên kết với hydrogen giảm dần
=> Xu hướng phản ứng của các đơn chất halogen với hydrogen giảm dần từ F2 đến I2