Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại? A. electron. B. neutron và electron. C. neutron. D. proton.

Ta có Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49:
=> 2Z + N = 49 (1)
Lại có, số hạt không mang điện bằng 53,125% số hạt mang điện:
=>N = 2Z x 53,125% = 1716Z
<=>17Z – 16N = 0 (2)
Từ (1) & (2) ta có: 2Z + N = 49
17Z – 16N = 0
=> Z=16 N =17
Vậy nguyên tử nguyên tố X có : điện tích hạt nhân là 16+, 16 proton, 16 electron, 17 neutron và có số khối là 33.

Ta có: P = E (Do nguyên tử trung hòa về điện)
- Tổng số p, e, e trong A và B là 142.
⇒ 2PA + NA + 2PB + NB = 142 (1)
- Tổng số hạt mang điện nhiều hơn số hạt không mang điện là 42.
⇒ 2PA + 2PB - NA - NB = 42 ⇒ NA + NB = 2PA + 2PB - 42 (2)
Thay (2) vào (1), được 4PA + 4PB = 184 (*)
- Số hạt mang điện của B nhiều hơn của A là 12.
⇒ 2PA - 2PB = 12 (**)
Từ (*) và (**) \(\Rightarrow\left\{{}\begin{matrix}P_A=26=Z_A\\P_B=20=Z_B\end{matrix}\right.\)
Vậy: Số hiệu nguyên tử của A và B lần lượt là 26 và 20.

Gọi kí hiệu của nguyên tử là X
\(p_X+n_X+e_X=37\)
\(\rightarrow2p_X+n_X=37\) (1)
\(2p_X-n_X=11\)(2)
Cộng 1 vào 2 , ta có :
\(4p_X=48\)
\(p_X=e_X=12\)
\(\rightarrow n_X=13\)
--> Mg ( Magie )

Theo đề , ta có :
\(P+N+E=18\)
\(\Leftrightarrow2P+N=18\)(nguyên tử trung hòa về điện)
\(\Rightarrow N=18-2P\left(1\right)\)
Có : \(1\le\dfrac{N}{P}\le1,5\)
\(\Leftrightarrow P\le18-2P\le1,5P\)
\(\Leftrightarrow3P\le18\le3,5P\)
\(\Leftrightarrow5,14\le P\le6\)
\(\Rightarrow P=E=6\) , \(N=6\)

Sửa đề: P ≤ N ≤ 1,33P → P ≤ N ≤ 1,5P (Đây là điều kiện bền của nguyên tử bạn nhé.)
Ta có: P + N + E = 10
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 10 ⇒ N = 10 - 2P
Có: P ≤ N ≤ 1,5P
⇒ P ≤ 10 - 2P ≤ 1,5P
⇒ 2,85 ≤ P ≤ 3,33
⇒ P = E = 3, N = 4
⇒ A = 3 + 4 = 7

a, Ta có: P = E (Do nguyên tử trung hòa về điện)
- Tổng số hạt p, n, e trong A là 214.
⇒ 4.2PM + 4NM + 3.2PX + 3NX = 214 (1)
- Tổng số hạt p, n, e của [M]4 nhiều hơn so với [X]3 trong A là 106.
⇒ 4.2PM + 4NM - 3.2PX - 3NX = 106 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}2P_M+N_M=40\\2P_X+N_X=18\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}N_M=40-2P_M\\N_X=18-2P_X\end{matrix}\right.\)
Luôn có: \(1\le\dfrac{N}{P}\le1,5\)
\(\Rightarrow\left\{{}\begin{matrix}P_M\le40-2P_M\le1,5P_M\\P_X\le18-2P_X\le1,5P_X\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}11,4\le P_M\le13,3\\5,1\le P_X\le6\end{matrix}\right.\)
⇒ PM = 12 (Mg) hoặc PM = 13 (Al)
PX = 6 (C)
Mà: A có CTHH dạng M4X3 nên A là Al4C3.
b, Al: 1s22s22p63s23p1
C: 1s22s22p2
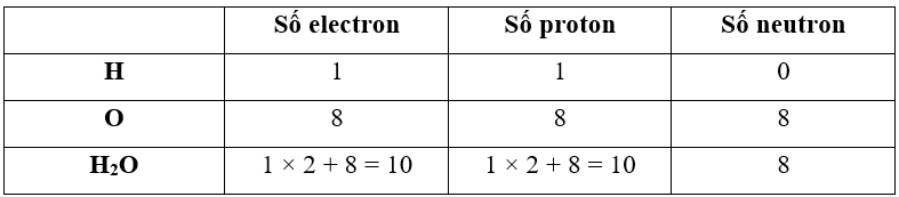
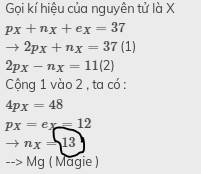
proton, electron
Chọn đáp án C.