Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a: X có 10electron và có 2 lớp electron
b: X là neon
c: Oxy, Nitơ,cacbon

Cấu hình: 1s22s22p63s23p3
=> Vì e ngoài cùng điền ở phân lớp 3p, và có 5e lớp ngoài cùng
=> Nguyên tử nguyên tố này thuộc chu kì 3 và có 3 lớp e

`1,`
Số electron lớp ngoài cùng của nguyên tử nguyên tố `Al` là `3`
Gt: Nguyên tố `Al` thuộc nhóm `IIIA`
Vì số nhóm `A` bằng số electron lớp ngoài cùng của các nguyên tử nguyên tố thuộc nhóm đó `-> Al` có `3e` lớp ngoài cùng.
Tương tự, `Cl` thuộc nhóm `VIIA ->` nguyên tố `Cl` có `7e` lớp ngoài cùng.
`2,`
Các nguyên tố thuộc chu kì và cùng nhóm với nguyên tố `Be:`
Chu kì: `Li, B, C, N, O, F, Ne`
Nhóm: `Mg, Ca, Sr, Ba, Ra`
1. Cấu hình e của Al (Z=13): 1s22s22p63s23p1
=> Có 3e lớp ngoài cùng (3e lớp thứ 3)
Cấu hình e của S (Z=16): 1s22s22p63s23p23p4
=> Có 6e lớp ngoài cùng (6e lớp thứ 3)

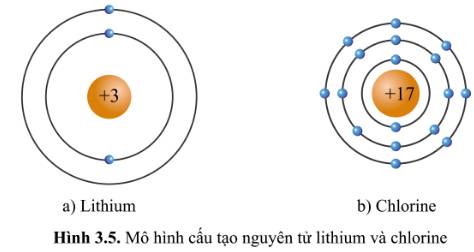
- Xét mô hình cấu tạo của nguyên tử lithium: có 1 hình tròn xanh ở vòng tròn ngoài cùng => Có 1 electron ở lớp vỏ ngoài cùng => Thuộc nhóm IA
- Xét mô hình cấu tạo của nguyên tử chlorine: có 7 hình tròn xanh ở vòng tròn ngoài cùng => Có 7 electron ở lớp vỏ ngoài cùng => Thuộc nhóm VIIA

- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
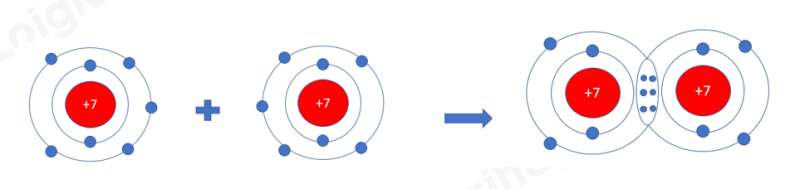
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
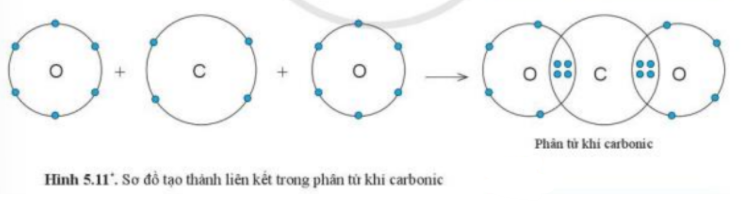
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung

Cấu hình X: 1s22s22p1
=> X có 5e => STT ô thứ 5, chu kì 2, nhóm IIIA

- Nguyên tố carbon:
+ Có số hiệu nguyên tử: 6
+ Nằm ở chu kì 2 => Có 2 lớp electron
- Nguyên tố nhôm:
+ Có số hiệu nguyên tử: 13
+ Nằm ở chu kì 3 => Có 3 lớp electron

- Nguyên tố X nằm ở chu kì 2, nhóm VA => Hàng số 2, cột VA
=> Nguyên tố phosphorus
+ Tên nguyên tố: Phosphorus
+ Kí hiệu hóa học: P
+ Khối lượng nguyên tử: 31
+ Ví trí ô của nguyên tố trong bảng tuần hoàn = số hiệu nguyên tử = 15
+ Ô nguyên tố có màu hồng => Phi kim

`#3107.101107`
a.
Gọi số hạt proton, neutron, electron trong nguyên tử X lần lượt là `p, n, e`
Tổng số hạt trong nguyên tử X là `48`
`=> p + n + e = 48`
Mà trong nguyên tử, số `p = e`
`=> 2p + n = 48`
Mà số hạt `p = n`
`=> 3p = 48`
`=> p = 48 \div 3`
`=> p = 16`
Vậy, số `p = n = e = 16`
b.
Khối lượng nguyên tử X là: `16 + 16 = 32` (amu)
c.
Bạn tham khảo mô hình NT X:
- X có `3` lớp electron
- X có `6` electron lớp ngoài cùng.
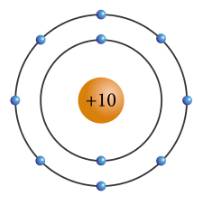

x = natri
tk
https://tech12h.com/de-bai/nguyen-x-z-11-la-nguyen-co-trong-thanh-phan-cua-muoi-hay-cho-biet-ten-nguyen-x-va-ve-mo-hinh