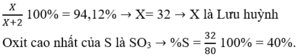Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Nguyên tố R có cấu hình e lớp ngoài cùng là ns1
=> Công thức oxit cao nhất của R là R2O
\(\dfrac{2.M_R}{2.M_R+16}.100\%=74,19\%=>M_R=23\left(Na\right)\)
b)
TH1:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
______0,2----------------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
TH2:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2HCl --> 2NaCl + H2
_____0,2------------------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
c)
K --> K+ + 1e
O + 2e --> O2-
2 ion K+ và O2- trái dấu nên hút nhau bởi lực hút tĩnh điện
2K+ + O2- --> K2O

1)
a. Vì R có công thức oxit cao nhất là \(RO_3\) nên nên trong hợp chất với hidro, hợp chất của R sẽ có dạng: \(H_2R\).
Theo đề, trong \(H_2R\) có 94,12% \(R\) về khối lượng:
\(\Leftrightarrow\dfrac{R}{2+R}.100=94,12\Leftrightarrow R=32\)
Vậy R là \(S\) (lưu huỳnh); công thức oxit cao nhật của lưu huỳnh là \(SO_3\).
b. Có: \(n_{SO_3}=\dfrac{8}{80}=0,1\left(mol\right);n_{NaOH}=0,15.0,1=0,015\left(mol\right)\)
Có tỉ lệ: \(\dfrac{n_{SO_3}}{n_{NaOH}}=\dfrac{0,015}{0,1}=0,15< 1\)
\(\Rightarrow\) Muối sau phản ứng là NaHSO3.
PTHH: \(SO_3+NaOH\rightarrow NaHSO_3\)
0,015(mol) --> 0,015(mol)
Vì \(n_{SO_3}>n_{NaOH}\) nên \(SO_3\) dư.
Theo phương trình, \(n_{NaHSO_3}=n_{NaOH}=0,015\left(mol\right)\)
\(\Rightarrow m_{NaHSO_3}=0,015.104=1,56\left(g\right)\)
2)
a. Vì R có cấu hình electron lớp ngoài cùng là \(ns^2np^3\) nên trong hợp chất với oxi, công thức oxit cao nhất của R có dạng: \(R_2O_5\).
Theo đề, trong \(R_2O_5\), Oxi chiếm 56,34% về khối lượng.
\(\Leftrightarrow\dfrac{16.5}{2R+16.5}.100=56,34\Leftrightarrow R=31\)
Vậy R là P - Photpho.
b. Theo đề: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
PTHH: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
0,1(mol) ------------> 0,2(mol)
Theo phương trình \(\rightarrow n_{H_3PO_4}=2n_{P_2O_5}=0,2\left(mol\right)\)
\(\Rightarrow m_{H_3PO_4}=0,2.98=19,6\left(g\right)\)
Mặt khác: mdung dịch thu được = \(m_{P_2O_5}+m_{H_2O}\)
= \(14,2+100=114,2\left(g\right)\)
\(\Rightarrow C\%_{H_3PO_4}=\dfrac{m_{H_3PO_4}}{m_{dd}}.100=\dfrac{19,6}{114,2}.100=17,163\%\)

Chọn B
Công thức hợp chất khí là X H 2
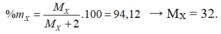
Vậy X là lưu huỳnh (S).
Công thức oxit cao nhất là S O 3
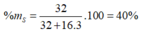

Đáp án D
X có cấu hình electron lớp ngoài cùng là ns2np4 → hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có
![]() .100% = 94,12% → X= 32 → X là Lưu huỳnh
.100% = 94,12% → X= 32 → X là Lưu huỳnh
Oxit cao nhất của S là SO3 → %S = ![]() .100% = 40%
.100% = 40%