Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án là A.
Phương trình phản ứng
Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2
Gọi x, y lần lượt là số mol Fe và Zn trong hỗn hợp
số mol H2 là nH2 = 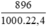 = 0,04(mol)
= 0,04(mol)
Giải hệ phương trình ta có: x = 0,03; y = 0,01.
Thành phần % theo khối lượng hỗn hợp là :
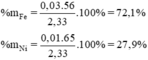

Chọn A.
Zn + 2H+ → Zn2+ + H2
Fe + 2H+ → Fe2+ + H2
= 0,04 (mol)
Gọi x và y là số mol của Zn và Fe
Ta có hệ phương trình:
=> x = 0,01; y = 0,03
%mZn = .100% = 27,9%; %mFe = 72,1%
Ngân 2,33 gam hợp kim Fe-Zn trong lượng dư dung dịch HCl đến khi phản ứng xẩy ra hoàn toàn thấy giải phóng 896 ml khí H2 (đktc). Thành phần phần trăm về khối lượng của hợp kim này là
A. 27,9% Zn và 72,1% Fe
B. 26,9% Zn và 73,1% Fe
C. 25,9% Zn và 74,1% Fe
D. 24,9% Zn và 75,1% Fe

Ta có mMuối = mKim loại + mCl–
Û mMuối = mKim loại + nH2 × 71 = 2,33 + 0,04 × 71mol.
⇒ mMuối = 5,17 gam
Đáp án A

a) Đặt \(\hept{\begin{cases}n_{Al}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{cases}}\)
PTHH : \(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al+6HNO_3-->Al\left(NO_3\right)_3+3NO_2+3H_2O\) (2)
\(Cu+4HNO_3-->Cu\left(NO_3\right)_2+2NO_2+2H_2O\) (3)
Theo pthh (1) : \(n_{Al}=\frac{2}{3}n_{H_2}=0,2\left(mol\right)\) => \(x=0,2\left(mol\right)\)
Theo ptr (2); (3) : \(n_{NO_2}=3n_{Al}+2n_{Cu}\)
=> \(0,8=0,2\cdot3+2\cdot n_{Cu}\)
=> \(n_{Cu}=0,1\left(mol\right)\)
=> \(a=0,2\cdot27+0,1\cdot64=11,8\left(g\right)\)
b) PTHH : \(NH_3+HNO_3-->NH_4NO_3\) (4)
\(3NH_3+3H_2O+Al\left(NO_3\right)_3-->Al\left(OH\right)_3\downarrow+3NH_4NO_3\) (5)
\(2NH_3+2H_2O+Cu\left(NO_3\right)_2-->Cu\left(OH\right)_2\downarrow+2NH_4NO_3\) (6)
BT Al : \(n_{Al\left(OH\right)_3}=n_{Al}=0,2\left(mol\right)\)
BT Cu : \(n_{Cu\left(OH\right)_2}=n_{Cu}=0,1\left(mol\right)\)
=> \(m\downarrow=m_{Al\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=25,4\left(g\right)\)
c) Gọi tên KL là X .
PTHH : \(2Al\left(NO_3\right)_3-t^o->Al_2O_3+6NO_2+\frac{3}{2}O_2\) (7)
\(Cu\left(NO_3\right)_2-t^o->CuO+2NO_2+\frac{1}{2}O_2\) (8)
\(4NO_2+O_2+2H_2O-->4HNO_3\) (9)
\(3X+4nHNO_3-->3X\left(NO_3\right)_n+nNO+2nH_2O\) (10)
viết ptr rồi, nhưng mik có thắc mắc là cho khí B hấp thụ vô nước => tính đc số mol của hno3, rồi áp vô X là ra, nhưng đề lại cho số mol NO =((( hoặc có thể dùng số mol NO để tính nhưng như thế có hơi thừa ko ? tính ra theo 2 cách thì cx ra 2 kq khác nhau ? ai githich giùm mik, hay mik tính sai hoặc phân tích đề sai nhỉ ?? :D

Gọi a,b,c,d lần lượt là số mol của Al,Mg,Fe,Zn
Số mol H2 thu được n = = 0,065
Phương trình phản ứng khi cho hỗn hợp tác dụng với axit
Al Al3+ + 3e
a mol 3a mol
Mg Mg2+ + 2e
b mol 2b mol
Fe Fe2+ + 2e
c mol 2c mol
Zn Zn2+ + 2e
d mol 2d mol
2H+ +2e H2
2.0,065 0,065
ta có phương trình :
3a +2b + 2c + 2d =2.0,065 =0,13 (1)
Khi cho hỗn hợp trên tác dụng với clo thu được muối.như vậy khối lượng Clo có trong muối là : mCl2 = m+ 4,97 –m =4,97 gam
Suy ra nCl2 = 0,07 mol
Tuong tự như phương trình phản ứng trên ta có phương trình toán học
3a +3b + 2c + 2d =0,07.2 =0,14 (2)
Lấy (2) – (1) ta có : b=0,01 .suy ra khối lượng Fe = 0,01 . 56 = 0,56 g

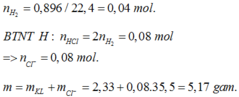
\(Đặt:n_{Fe}=a\left(mol\right);n_{Zn}=b\left(mol\right)\\ n_{H_2}=\dfrac{896:1000}{22,4}=0,04\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}56a+65b=2,33\\a+b=0,04\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,03\\b=0,01\end{matrix}\right.\\ \Rightarrow\%m_{Fe}=\dfrac{0,03.56}{2,33}.100\approx72,1\%\\ \Rightarrow\%m_{Zn}\approx27,9\%\\ \Rightarrow A\)