Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những ứng dụng của photpho như SGK. Mỗi ứng dụng đó xuất phát từ tính khử hoặc tính oxi hóa của photpho.

a) Tăng
\(4P+5O_2\) \(\underrightarrow{to}\) \(2P_2O_5\)(tăng từ 0 lên +5)
b) Giảm:
\(2P+3Ca\) \(\underrightarrow{to}\) \(Ca_3P_2\) (giảm từ 0 xuống -3)

- Tính chất:
+ Tính chất vật lí: Ở điều kiện thường, các dẫn xuất halogen có phân tử khối nhỏ ở thể khí. Các dẫn xuất halogen có phân tử khối lớn hơn thưởng ở thể lỏng hoặc ở thể rắn. Phần lớn dẫn xuất halogen nặng hơn nước và hầu như không tan trong nước, tan tốt trong dung môi hữu cơ kém phân cực như hydrocarbon, ether,...
+ Tính chất hóa học: Do halogen có độ âm điện lớn hơn carbon nên cặp electron dùng chung trong liên kết C-X (X là F, Cl, Br và I) bị hút về phía nguyên tử halogen, làm cho nguyên tử halogen mang một phần điện tích âm, nguyên tử carbon mang một phần diện tích dương và liên kết C−X phân cực. Nhờ có sự phân cực của liên kết C−X, dẫn xuất halogen dễ tham gia vào nhiều phản ứng hoá học. Hai loại phân ứng hoá học quan trọng của dẫn xuất halogen là phản ứng thể nguyên tử halogen và phản ứng tách hydrogen halide.
- Ứng dụng:
+ Làm dung môi, làm nguyên liệu: chloroform (CHCl3), carbon tetrachloride (CCl4),…
+ Làm chất gây mê, giảm đau: chloroform (CHCl3), ethyl chlordide,…
+ Thuốc trừ sâu: 2,4 – D, 2,4,5 – T,…
+ Chất dùng trong công nghệ làm lạnh: chlorofluorocarbon (CFC), hydrofluorocarbon (HFC).

(1) sai, khoáng vật chính của photpho trong tự nhiên là apatit và photphorit
(2) đúng
(3) đúng
(4) sai, trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng giữa P và
H
N
O
3
đặc
(5)sai, P hoạt động hơn N do N tồn tại ở
N
2
có liên kết ba bền
Đáp án B
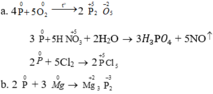
- Ứng dụng:
+ P đỏ được dùng trong sản xuất diêm.
+ Điều chế axit photphoric, thuốc trừ sâu chứa photpho…
+ Dùng trong quân sự: sản xuất bom, đạn cháy, đạn khói…
+ Photpo còn là một nguyên tố rất cần cho con người nhất là trí thông minh, sáng tạo, phát triển xương. Cần cho cây nhất là cấy ăn quả.
- Những ứng dụng đó xuất phát từ tính khử và tính oxi hoá của photpho.