Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Dẫn khí methane vào bình chứa khí Clo trong điều kiện ánh sáng. Sau đó cho mẫu giấy quỳ tím ẩm vào.
=> bình mất màu vàng của clo , quỳ chuyển đỏ
Cl2+CH4->CH3Cl+HCl
b. Dẫn khí methane đi qua dung dịch bromine
ko hiện tượng
c. Dẫn khí ethylene đi qua dung dịch bromine
dd trở nên trong suốt
C2H4+Br2-to>C2H4Br2
d. Dẫn khí acetylene đi qua dung dịch bromine dư
dd trở nên nhạt
C2H2+2Br2->C2H2Br4

- Hiện tượng: hỗn hợp rắn tan
P2O5 + 3H2O --> 2H3PO4
NaOH + H3PO4 --> NaH2PO4 + H2O

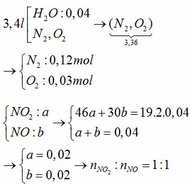
Tỉ lệ mol của 2 khí NO2 và NO là 1:1, khí O2 không đủ nên giả sử mol pứ đều là: x (mol)
2NO2 + ½ O2 + H2O → 2HNO3
x→ 0,25x x
2NO + 1,5O2 + H2O → 2HNO3
x → 0,75x x
pứ: x 2x
nO2 = 0,03 => x = 0,03
=> nHNO3 = 0,06
mbình sau pứ = N2 + mO2 + mH2O+ mNO2 + mNO = 28 . 0,12 + 32 . 0,03 + 40 + 19 . 2 . 0,04 = 45,84g
=> %HNO3 = 8,246%

Gọi: \(\left\{{}\begin{matrix}n_{C_3H_8}=a\left(mol\right)\\n_{C_xH_y}=2a\left(mol\right)\\n_{C_xH_{2x}}=3a\left(mol\right)\end{matrix}\right.\) (trong 16,128 (l))
\(\Rightarrow a+2a+3a=\dfrac{16,128}{22,4}=0,72\left(mol\right)\Rightarrow a=0,12\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{C_3H_8}=0,12\left(mol\right)\\n_{C_xH_y}=0,24\left(mol\right)\\n_{C_xH_{2x}}=0,36\left(mol\right)\end{matrix}\right.\)
Ta có: m bình 1 tăng = mH2O \(\Rightarrow n_{H_2O}=\dfrac{56,16}{18}=3,12\left(mol\right)\)
BTNT H, có: 0,12.8 + 0,24y + 0,36.2x = 3,12.2 (1)
Ta có: \(n_{Ba\left(OH\right)_2}=2.1,19=2,38\left(mol\right)\), \(n_{BaCO_3}=\dfrac{394}{197}=2\left(mol\right)\)
BTNT Ba, có: \(n_{Ba\left(HCO_3\right)_2}=2,38-2=0,38\left(mol\right)\)
BTNT C, có: 0,12.3 + 0,24.x + 0,36.x = nCO2 = nBaCO3 + 2nBa(HCO3)2 = 2 + 0,38.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=4\\y=10\end{matrix}\right.\)
Vậy: CTPT cần tìm là C4H10 và C4H8.
Hỗn hợp T gồm 2 hidrocacbon → T gồm C3H8 và C4H10.
→ Chỉ C4H8 pư với Br2.
Ta có: \(n_{C_4H_8}=n_{Br_2}=0,18\left(mol\right)\)
\(\Rightarrow n_{C_3H_8}=\dfrac{0,18}{3}=0,06\left(mol\right)\)
\(n_{C_4H_{10}}=\dfrac{0,18}{3}.2=0,12\left(mol\right)\)
⇒ mZ = mC3H8 + mC4H10 + mC4H8 = 0,06.44 + 0,12.58 + 0,18.56 = 19,68 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{C_3H_8}=\dfrac{0,06.44}{19,68}.100\%\approx13,41\%\\\%m_{C_4H_{10}}=\dfrac{0,12.58}{19,68}.100\%\approx35,37\%\%\\\%m_{C_4H_8}\approx51,22\%\end{matrix}\right.\)

1. Mẩu kẽm tan dần, có hiện tượng sủi bọt khí.
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
2. Xuất hiện kết tủa trắng.
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_{4\downarrow}\)
3. Ban đầu quỳ tím hóa xanh, sau khi cho HCl vào, quỳ tím dần trở lại màu tím. Khi HCl dư, quỳ tím hóa đỏ.
PT: \(HCl+NaOH\rightarrow NaCl+H_2O\)
4. Đinh sắt tan dần, có chất rắn màu đỏ đồng bám vào đinh sắt, màu xanh của dd nhạt dần.
PT: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
5. Xuất hiện bọt khí.
PT: \(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
6. Chất rắn chuyển từ màu xanh sang đen, có hơi nước thoát ra.
PT: \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
7. Xuất hiện kết tủa xanh.
PT: \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)

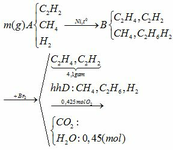
C2H2 + H2 C2H4
C2H2 + H2 C2H6
Khi cho hỗn hợp B qua dd nước Br2 chỉ có C2H4 và C2H2 phản ứng C2H2 +2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
=> khối lượng bình Br2 tăng chính bằng khối lượng của C2H2 và C2H4
mC2H2 + mC2H4 = 4,1 (g)
Hỗn hợp khí D đi ra là CH4, C2H6 và H2
CH4 + 2O2 → t ∘ CO2 + 2H2O
C2H6 + O2 → t ∘ 2CO2 + 3H2O
2H2 + O2 → t ∘ 2H2O
Bảo toàn nguyên tố O cho quá trình đốt cháy hh D ta có:
2nCO2 = 2nO2 – nH2O => nCO2 = ( 0,425. 2– 0,45)/2 = 0,2 (mol)
Bảo toàn khối lượng : mhh D = mCO2 + mH2O – mO2 = 0,2.44 + 0,45.18 – 0,425.32 = 3,3 (g)
Bảo toàn khối lương: mA = (mC2H2 + mC2H4) + mhh D = 4,1 + 3,3 = 7,4 (g)