Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=\dfrac{64.50}{100}=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2

Công thức hóa học: S x O y
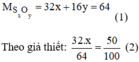
Giải phương trình (2) ta được: x = 1 thay vào pt (1) ⇒ y = 2.
Vậy công thức hóa học của oxit là S O 2

Câu 1 :
\(M_{K_2CO_3}=39.2+12+16.3=138\left(dvC\right)\)
\(\%K=\dfrac{39.2}{138}.100\%=56,52\%\)
\(\%C=\dfrac{12}{138}.100\%=8,69\%\)
\(\%O=100\%-56,52\%-8,69\%=34,79\%\)
Còn lại cậu làm tương tự nhá

Ta có:
\(m_S=64.50\%=32g\)
\(m_O=64.50\%=32g\)
=> \(n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(n_O=\dfrac{32}{16}=2\left(mol\right)\)
Vậy CTHH của oxit đó là \(SO_2\)

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?

Phân tử khối của Đồng ôxit và Đồng sunfat có tỉ lệ 1/2
Mà phân tử khối của đồng sunfat (CUSO4) là 160 đvC
=> Phân tử khối của đồng oxit là :
160 * 1/2 = 80 (đvC)
Do đồng oxit gồm Cu và O nêncông thức hóa học của đồng oxit có dạng CuxOy
Ta có :
PTKđồng oxit = NTKCu * x + NTKO * y
=> 80 đvC = 64 * x + 16 * y
=> x < 2 vì nếu x = 2 thì 64 * 2 > 80
=> x = 1 , khi đó :
y = ( 80 - 64*1 ) : 16 = 1
Vậy công thức hóa học của đồng oxit là CuO
b) Gọi công thức của oxit là SxOy
x : y = nS : nO =
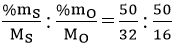
= 1,5625 : 3,125 = 1 : 2
Vậy công thức đơn giản của hợp chất M là: SO2

Khối lượng của các nguyên tố trong hợp chất là:
\(m_{FE}=\dfrac{70.160}{100}=112\left(g\right)\)
\(m_O=\dfrac{30.160}{100}=48\left(g\right)\)
Số mol có trong mỗi nguyên tố là:
\(n_{FE}=\dfrac{m_{FE}}{M_{FE}}=\dfrac{112}{56}=2\left(mol\right)\)
\(n_O=\dfrac{m_O}{M_O}=\dfrac{48}{16}=3\left(mol\right)\)
Vậy hợp chất có 2 nguyên tử Fe, 3 nguyên tử O
Công thức hóa học của hợp chất là: \(FE_2O_3\)

Gọi số nguyên tử lưu huỳnh trong phân tử hợp chất là x (nguyên tử), số nguyên tử oxi là y (nguyên tử). ĐK: \(x;y\in \mathbb N^*\)
Ta có:
\(\left\{{}\begin{matrix}\dfrac{32x}{32x+16y}\cdot100=50\\\dfrac{16y}{32x+16y}\cdot100=50\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=1\\y=2\end{matrix}\right.\) (TMĐK)
Vậy công thức hoá học của hợp chất đã cho là SO2.
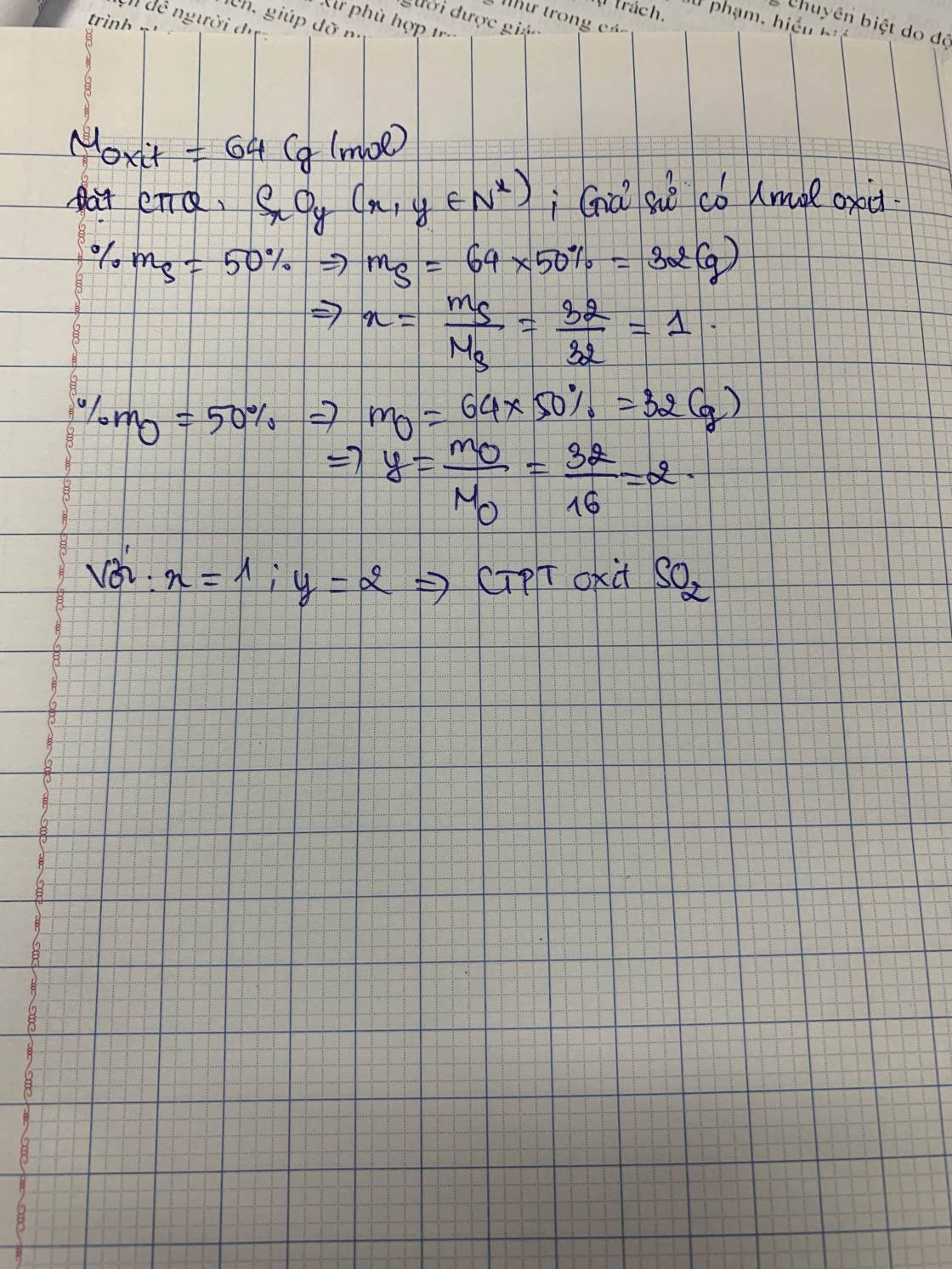
Ta có: \(\left\{{}\begin{matrix}m_S=64\cdot50\%=32\left(g\right)\\m_O=64\cdot50\%=32\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_S=\dfrac{32}{32}=1\left(mol\right)\\n_O=\dfrac{32}{16}=2\left(mol\right)\end{matrix}\right.\)
Vậy CTHH là \(SO_2\)
Sao lại nhân với 50% vậy?