Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
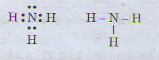

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
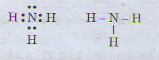

Tham khảo:
a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là nitơ. Công thức phân tử hợp chất với hidro là NH3.

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.

1/Đặt Z, N lần lượt là số hạt p, n có trong nguyên tử M
ta có hệ phương trình
\(\begin{cases}2Z+N=79+3\\2Z-N=19+3\end{cases}\)\(\Rightarrow\begin{cases}Z=26\\N=30\end{cases}\)
a. Cấu hình electron nguyên tử của M là: 1s22s22p63s23p63d64s2
M ở ô thứ 26, chu kì 4 nhóm VIIIB trong bảng tuần hoàn.
b. Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
Cấu hình electron của ion Fe3+ là: 1s22s22p63s23p63d5
2.
Vì R tạo được hợp chất khí với H nên R là phi kim.
Giả sử R thuộc nhóm x (x\(\ge\)4).
Theo giả thiết
công thức của R với H là RH8-x \(\Rightarrow\)a=\(\frac{R}{R+8-x}.100\)
công thức oxit cao nhất của R là R2Ox
\(\Rightarrow\) b=\(\frac{2R}{2R+16x}.100\) \(\Leftrightarrow\) b= \(\frac{R}{R+8x}.100\)
suy ra \(\frac{a}{b}=\frac{R+8x}{R+8-x}=\frac{11}{4}\)\(\Leftrightarrow R=\frac{43x-88}{7}\)
Xét bảng
x R 4 5 6 7 12 có C 18,14 loại 24,28 loại 30,42 loại
a/ Vậy R là C
b/
Công thức của R với H là CH4
Công thức electron C : H : H : H : H ; Công thức cấu tạo C - H - - - H H H
Oxti cao nhất của R là CO2
Công thức electron O:: C ::O; Công thức cấu tạo O=C=O
c.
Trong hợp chất CH4 có \(\Delta\chi=\chi_C-\chi_H\)=2,55-0,22=0,35<0,4 nên liên kết giữa C-H là liên kết cộng hóa trị không cực
Trong hợp chất CO2 có 0, \(\Delta\chi=\chi_O-\chi_C\) =3,44-2,55=0,89
\(\Rightarrow\) 0,4<\(\Delta\chi=0,89\)<1,7 nên liên kết giữa C=O là liên kết cộng hóa trị phân cực

Câu 1:
a. Để viết cấu hình electron của nguyên tử nguyên tố R, chúng ta cần biết số hiệu nguyên tử của nó. Trong trường hợp này, số hiệu nguyên tử của R là 16. Với số hiệu nguyên tử này, cấu hình electron của R là: 1s2 2s2 2p6 3s2 3p4.
b. Để xác định xem R là kim loại, phi kim hay khí hiếm, chúng ta cần xem xét vị trí của nó trong bảng tuần hoàn. Tuy nhiên, không có thông tin cụ thể về vị trí của R trong bảng tuần hoàn, do đó không thể xác định được liệu R là kim loại, phi kim hay khí hiếm.
c. Vì không có thông tin cụ thể về vị trí của R trong bảng tuần hoàn, chúng ta không thể xác định được vị trí cụ thể của nó.
d. Để viết công thức hợp chất khí với hydrogen, chúng ta cần biết valency của R. Tuy nhiên, không có thông tin về valency của R, do đó không thể viết công thức hợp chất khí với hydrogen.
e. Để viết công thức hydroxide tương ứng với oxide cao nhất của R, chúng ta cần biết valency của R. Tuy nhiên, không có thông tin về valency của R, do đó không thể viết công thức hydroxide tương ứng.
Câu 2:
- BKNT (Bán kính nguyên tử): BKNT tăng dần từ trái sang phải và giảm dần từ trên xuống dưới trong bảng tuần hoàn. Điều này có nghĩa là các nguyên tử bên phải và phía dưới trong bảng tuần hoàn có BKNT nhỏ hơn.
- Độ ẩm điện: Độ ẩm điện tăng dần từ trái sang phải và giảm dần từ trên xuống dưới trong bảng tuần hoàn. Các nguyên tử bên phải và phía dưới trong bảng tuần hoàn có độ ẩm điện cao hơn.
- Tính kim loại: Tính kim loại tăng dần từ phải sang trái và từ trên xuống dưới trong bảng tuần hoàn. Các nguyên tử bên trái và phía trên trong bảng tuần hoàn có tính kim loại cao hơn.
- Tính phi kim: Tính phi kim giảm dần từ phải sang trái và từ trên xuống dưới trong bảng tuần hoàn. Các nguyên tử bên phải và phía trên trong bảng tuần hoàn có tính phi kim cao hơn.
Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là nitơ. Công thức phân tử hợp chất với hidro là NH3.