Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

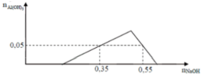
Tại nOH- = 0,35 thì Al(OH)3 chưa đạt cực đại ⇒ Al3+ còn dư
H+ + OH- → H2O
Al3+ + 3OH- → Al(OH)3
⇒ nOH- = nH+ + 3n↓ ⇒ 0,35 = x + 3.0,05 ⇒x = 0,2
Tại nOH- = 0,55 thì Al(OH)3 đạt cực đại và bị tan bớt 1 phần
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
y → 3y → y
Al(OH)3 + OH- → AlO2- + 2H2O
(y – 0,05) → (y – 0,05
⇒ nOH- = 0,2 + 3y + y – 0,05 = 0,55 ⇒ y = 0,1
Bảo toàn điện tích ⇒ 0,2 + 0,1.3 = 2z + 0,1 ⇒z = 0,2
Khi cho 0,27 mol Ba(OH)2 vào dung dịch X thì
Ba2+ + SO42- → BaSO4↓
0,2 → 0,2
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
0,1 → 0,3 → 0,1
Al(OH)3 + OH- → AlO2- + 2H2O
0,04 ← 0,04
⇒ mY = mBaSO4 + mAl(OH)3 = 0,2.233 + 0,06.78 = 51,28g ⇒ Chọn D.

Phân tích thí nghiệm của dung dịch X với NaOH
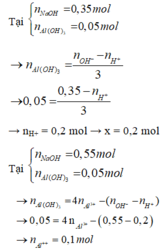

Thí nghiệm 2
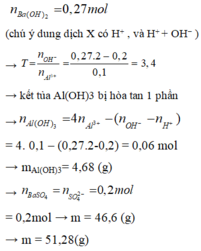
Đáp án C

Gọi số mol H + , Al 3 + , SO 4 2 - trong mỗi phần là x, y, z
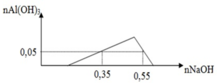
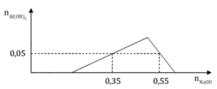
Tại A, khi nhỏ một lượng 0,3 mol NaOH, ta có:
0,3 = x + 0,05.3 → x = 0,15 mol
Áp vào điểm B, khi nhỏ một lượng 0,5 mol NaOH, ta có quá trình hòa tan khi kết tủa đạt cực đại xuống còn 0,05 mol kết tủa là:
n ↓ = 4 n Al 3 + - n OH - = 0 , 05 mol (do trung hoà axit, n OH - dung cho kết tủa chỉ là: 0,5 – 0,15 = 0,35 mol)
→ 4.y = 0,35
+ 0,05 → y = 0,1 mol
Bảo toàn điện tích suy ra dung dịch X gồm:
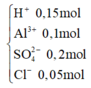
Khi nhỏ Ba(OH)2 vào dung dịch X thì mất 0,075mol Ba(OH)2trung hòa lượng H+, còn lại 0,105 mol Ba(OH)2tác dụng với Al3+
Vậy nAl(OH)3 = 0,21 :3 = 0,07 mol
m↓ = 0,07.78 + 0,18,233 = 47,4 gam
Đáp án B

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Coi như cho cả X và H2SO4 cùng lúc vào dd kiềm (vừa đủ) thì kết quả sinh ra vẫn là muối và nước. Dung dịch sau cùng chưa các ion: \(H_2N-C_xH_y-\left(COO\right)^{2-};K^+;Na^+;SO_4^{2-}.\)
Có ngay: \(n_{H^+}=n_{OH^-}=2n_X+2n_{H_2SO_4}=0,4\left(mol\right)\)
Mà \(n_{K+}=3n_{Na+}\Rightarrow n_{K+}=0,3\left(mol\right);n_{Na+}=0,1\left(mol\right)\)
\(m_{H_2N-C_xH_y-\left(COO\right)^{2-}}=m_{muối}-m_{K+}-m_{Na+}-m_{SO_4^{2-}} \\ =36,7-0,3\cdot39-0,1\cdot23-0,1\cdot96=13,1\left(gam\right)\)
\(M_{H_2N-C_xH_y-\left(COO\right)^{2-}}=\frac{13,1}{0,1}=131\\ \Rightarrow M_X=131+2=133\\ \Rightarrow\%N=\frac{14}{133}\cdot100\%\approx10,526\%\)
cho m gam axit glutamicvaof dung dịch NAOH thu được dd X chứa 23,1 gam chất tan . để tác dụng vừa đủ với chất tantrong X cần dùng 200ml dung dịch HCL 1M và H2S4O 0,5M thu được dung dịch chứa 38,4 gam hỗn hợp muối .m=?

nCu = 0,02; nAg = 0,005 → Tổng số mol e cho tối đa: = 0,02.2 + 0,005.1 = 0,45
nH+ = 0,09; nNO3- = 0,06 (dư)
4H+ + NO3- + 3e → NO + 2H2O
0,06 0,045 0,015
Cu, Ag đã phản ứng hết
2NO + O2 → 2NO2
0,015 0,0075 0,015
4NO2 + O2 + 2H2O → 4HNO3
0,015 0,015
Nồng độ mol HNO3 = 0,015:0,15 = 0,1 → pH = 1

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.
 với các chất sau:
với các chất sau:
Đáp án D
Ta có: x = 0,35 – 0,05.3 = 0,2
Tại điểm kết tủa cực đại là
=> z = 0,2.
Khi thêm 0,27 Ba(OH)2 thì thu được kết tủa Z chứa
=> m = 51,28 gam