Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trạng thái 1: T1 = t1 + 273 = 303 K; P1 = 2 bar
Trạng thái 2: P2 = 4 bar ; T2 = ?
Áp dụng định luật Sác-lơ cho quá trình biến đổi đẳng tích, ta có:
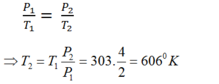

Ta có : T1 = toC + 273 = 30 + 273 = 303oK
p1 = 2 bar = 2 . 105 Pa
p2 = 4 bar = 4 . 105
Vì quá trình là đẳng tích , áp dụng định luật Charles ta có
\(\frac{p_1}{p_2}=\frac{T_1}{T_2}\)→ T2 = \(\frac{p_2.T_1}{p_1}=\frac{4.10^5.303}{2.10^5}\)= 606oK
Vậy để áp suất tăng lên gấp đôi , ta phải tăng nhiệt độ lên 606oK
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\frac{P1}{T1}=\frac{P2}{T2}\Rightarrow T2=\frac{P2.T1}{P1}=\frac{2P1.T1}{P1}\) = 2T1 = 606 K

t = 30*C => T = 303K
Quá trình đẳng tích thì áp suất tỉ lệ thuận với nhiệt độ.
Áp suất tăng gấp đôi thì nhiệt độ tăng gấp đôi => T' = 2T = 606K
=> t' = 606 - 273 = 333*C

Xét lượng khí còn lại trong bình
Trạng thái 1: V 1 = V/2; T 1 = 27 + 273 = 300 K; p 1 = 40 atm.
Trạng thái 2: V 2 = V; T 2 = 12 + 273 = 285 K; p 2 = ? atm,
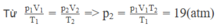

\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\)
Thể tích ko đổi => V1 = V2
=> \(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\)
\(\dfrac{p_1}{T_1}=\dfrac{p_1+2000}{T_1+100}\Leftrightarrow p_1T_1+100p_1=p_1T_1+2000\)
=> p1 = 20T1
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_1+150}\Rightarrow p_1T_1+150p_1=p_2T_1\)
-> (p2 - p1)T1 = 150p1 = 150.20T1
=> p2 - p1 = 3000 Pa
Vậy áp suất của khí tăng thêm 3000Pa

Trạng thái 1: \(\left\{{}\begin{matrix}p_1=2\cdot10^5Pa\\V_1=20cm^3\\T_1=17^oC=290K\end{matrix}\right.\)
Trạng thái 2: \(\left\{{}\begin{matrix}p_2=???\\V_2=10cm^3\\T_2=127^oC=400K\end{matrix}\right.\)
Quá trình khí lí tưởng:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Rightarrow\dfrac{20\cdot2\cdot10^5}{290}=\dfrac{p_2\cdot10}{400}\)
\(\Rightarrow p_2=5517241,4Pa\)

\(\left\{{}\begin{matrix}760mmHg=1atm\\750mmHg\approx0,9atm\end{matrix}\right.\)
Ta có
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\\ \Leftrightarrow\dfrac{1.0,1}{300}=\dfrac{0,9V_2}{400}\Rightarrow V_2\approx0,148=148cm^3\)
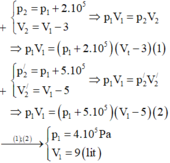
\(a,\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{T_1p_2}{p_1}=\dfrac{303.4.10^5}{2.10^5}=606^oK\\ b,T_2=\dfrac{303.10^5}{2.10^5}=151,5^oK\)