
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


X: Fe3O4
Y: FeCl2
Z: FeCl3
T: Fe(OH)2
U: Fe(OH)3
A: NaCl (hoặc H2O)
B: H2O (hoặc NaCl)
D: H2 (hoặc Cl2)
E: Cl2 (hoặc H2)
F: NaOH
G: HCl
PTHH:
a) NaCl + H2O -dpmn----> 1/2 H2 + 1/2 Cl2 + NaOH
H2 + Cl2 -to-> 2 HCl
HCl + NaOH -> NaCl + H2O
b) 3 Fe +2 O2 -to->Fe3O4
Fe3O4 + 8 HCl -> FeCl2 +2 FeCl3 + H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 +3 NaOH -> Fe(OH)3 + 3NaCl
Chúc em học tốt!

12.
Na2CO3+H2SO4->Na2SO4+H2O+CO2
............. 0,5 ............. ......... 0,5
CO2+2KOH->K2CO3+H2O
x 2x x
CO2+KOH->KHCO3
y y y
mKOH=98.40/100=39,2g
nKOH=39,2/56=0,7mol
Có:
2x+y=0,7
138x+100y=57,6
=>x=0,2mol; y=0,3mol
mK2CO3=138.0,2=27,6g
mKHCO3=57,6-27,6=30g
b.
nCO2=x+y=0,2+0,3=0,5mol
CMddH2SO4=0,5/0,2=2,5M
8. Hoàn thành sơ đồ chuyển hóa sau:
Mg \(\underrightarrow{\left(1\right)}\) MgO \(\underrightarrow{\left(2\right)}\) MgCl2 \(\underrightarrow{\left(3\right)}\) Mg(OH)2 \(\underrightarrow{\left(4\right)}\) MgO \(\underrightarrow{\left(5\right)}\) MgSO4 \(\underrightarrow{\left(6\right)}\) MgCO3 \(\underrightarrow{\left(7\right)}\) MgO
\(\left(1\right)2Mg+O_2\underrightarrow{t^o}2MgO\)
\(\left(2\right)MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(\left(3\right)MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\)
\(\left(4\right)Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
\(\left(5\right)MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(\left(6\right)MgSO_4+Na_2CO_3\rightarrow MgCO_3+Na_2SO_4\)
\(\left(7\right)MgCO_3\underrightarrow{t^o}MgO+CO_2\uparrow\)

$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(1)$
$Fe_2(SO_4)_3 + Fe\ to 3FeSO_4(2)$
Gọi $n_{Fe_2(SO_4)_3} = a(mol) ; n_{FeSO_4} = b(mol)$
Ta có : $400a + 152b = 62,8(1)$
$n_{SO_2} = 0,15(mol)$
$n_{Fe_2(SO_4)_3(1)} = \dfrac{1}{3}n_{SO_2} = 0,05(mol)$
$n_{Fe_2(SO_4)_3(2)} = \dfrac{1}{3}n_{FeSO_4} = \dfrac{b}{3}$
Suy ra:
$0,05 - \dfrac{b}{3} = a(2)$
Từ (1)(2) suy ra $a = \dfrac{45}{112} ; b = -1,055<0$
=> Sai đề


Đặt CTHH của oxit sắt cần tìm : FexOy
PTHH : FexOy + yH2 = xFe + yH2O
0.2
Theo giả thiết C%H2SO4 còn 98% -3.405%= 94.595%
Hoặc \(\dfrac{98}{100+m_{H2O}}\) =0.94595
giải được mH2O=3.6g
nH2O=0.2 mol
Chất rắn thu được là Fe , nH2 thoát ra=3.36/22.4=0.15 mol
PTHH : Fe + H2SO4 --> FeSO4 + H2
0.15 0.15
Ta có tỉ lệ : nFe:nH2O = x:y = 0,15:0,2 = 3:4
Vậy CTHH của oxit sắt là Fe3O4

a, Ta có nCO2 = \(\dfrac{11,2}{22,4}\) = 0,5 ( mol )
CO2 + NaOH → NaHCO3
x → x → x
CO2 + 2NaOH → Na2CO3 + H2O
y → 2y → y
Ta có \(\dfrac{x}{y}\) = \(\dfrac{2}{3}\)
=> x = \(\dfrac{2}{3}\)y
=> x - \(\dfrac{2}{3}\)y = 0
mà \(\left\{{}\begin{matrix}x-\dfrac{2}{3}y=0\\\text{x + y = 0,5}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\)
=> mNaOH = ( x + 2y ) . 40 = 0,6 . 40 = 24 ( gam )
Mdung dịch = Mtham gia
= mNaOH + mCO2
= 400 + 0,5 . 44
= 422 ( gam )
=> C%NaOH = \(\dfrac{24}{422}\) . 100 \(\approx\) 5,7%
b, => mNaHCO3 = 84 . 0,2 = 16,8 ( gam )
=> mNa2CO3 = 106 . 0,3 = 31,8 ( gam )
=> C%NaHCO3 = \(\dfrac{16,8}{422}\) . 100 \(\approx\) 4%
=> C%Na2CO3 = \(\dfrac{31,8}{422}\) . 100 \(\approx\) 7,54 %

alo giúp mik Nhân dịp đi du lịch về, Mai mang đến lớp 51 móc chìa khóa để tặng cho cácbạn. Sau khi chia hết cho các bạn (tính cả mình) thì Mai còn thừa3chiếc. Hỏi lớpMai có bao nhiêu bạn, biết số học sinh nhiều hơn 20 và ít hơn 30 bạn.

Bài 2 :
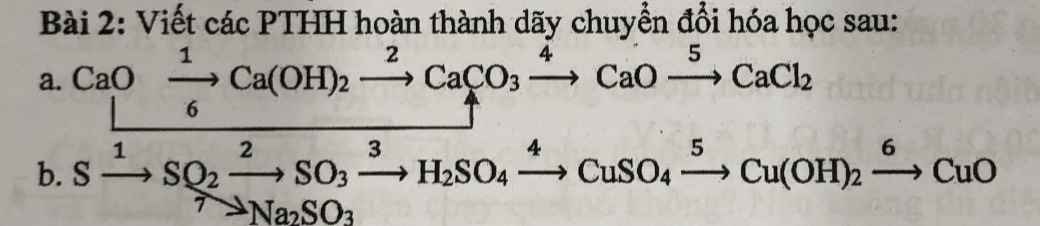
a) (1) \(CaO+CO_2\rightarrow CaCO_3\)
(2) \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
(3) \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
(4) \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
(5) \(CaO+2HCl\rightarrow CaCl_2+H_2O\)
Chúc bạn học tốt
b)(1) \(S+O_2\underrightarrow{t^o}SO_2\)
(2) \(2SO_2+O_2\underrightarrow{t^o,V_2O_5}2SO_3\)
(3) \(SO_3+H_2O\rightarrow H_2SO_4\)
(4) \(H_2SO_4+CuO\rightarrow CuSO_4+H_2O\)
(5) \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
(6) \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
(7) \(SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\)
Chúc bạn học tốt




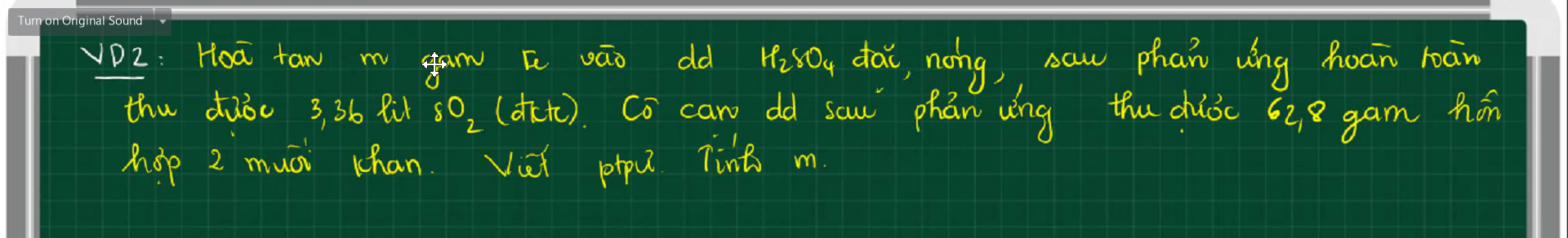


a) $n_{H_2} = \dfrac{4,48}{22,4} = 0,2 (mol)$
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2<-----------------------0,2
FeO + 2HCl ---> FeCl2 + H2O
b) \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{20}.100\%=56\%\\\%m_{FeO}=100\%-56\%=44\%\end{matrix}\right.\)