Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khí clo dư được loại bỏ bằng cách dẫn khí clo sục vào:
b) Dung dịch NaOH: do tạo thành muối NaCl, NaClO.
d) Nước: do tạo thành HCl và HClO.

Số mol MnO2 = 3,48 : 87 = 0,04 mol
Số mol NaOH = 0,1.0,8 = 0,08 mol
Ptpư: MnO2 + 4HCl ---> MnCl2 + Cl2 + 2H2O
Cl2 + 2NaOH---> NaCl + NaClO + H2O
Theo ptpư: mol NaOH = 2mol Cl2 ---> phản ứng vừa đủ
mol NaCl = mol NaClO = mol Cl2 = 0,04 mol
--->CM(NaCl) = CM(NaClO) = 0,04 : 0,8 = 0,05(M)

a) Không thể thu khí bằng cách đẩy nước, vì clo tan trong nước.
Khí clo không tác dụng với oxi nên được thu bằng cách đẩy không khí: Dẫn khí clo vào đáy bình thu đặt đứng, clo nặng hơn không khí sẽ chiếm dần từ phía dưới và đẩy không khí ra ngoài.
b) Vai trò của H2S04 đặc là hút nước có lẫn trong khí clo, làm khô khí clo.
không thể thu khí clo bằng cách đẩy nước vì clo tác dụng được với nước
pt Cl2+H2O\(⇌\)HCL+HCLO
có thể thu khí clo bằng cách đẩy không khí và để ngửa bình và khí clo nặng hơn không khí H2SO4đặc để hút nước

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

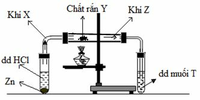
+ X là khí hiđro, kí hiệu H2
+ Y là đơn chất rắn màu vàng => Y là lưu huỳnh, kí hiệu S
+ Z là khí hiđro sunfua, kí hiệu H2S
+ Dung dịch T có màu xanh lam => T là dung dịch muối của đồng
Mà khối lượng mol của Y là 160 => T là muối đồng (II) sunfat, kí hiệu CuSO4

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

PTHH:
2Al+6HCl→2AlCl3+3H2
Fe+2HCl→FeCl2+H2
2NaOH+FeCl2→2NaCl+Fe(OH)2
3NaOH+AlCl3→3NaCl+Al(OH)3
NaOH+Al(OH)3→NaAlO2+2H2O
4Fe(OH)2+O2→2Fe2O3+4H2O
CO2+NaAlO2+2H2O→Al(OH)3+NaHCO3

Hốn hợp khí A gồm CO và CO2. Khí B là CO2. Hỗn hợp chất rắn C là Fe và FeO. Kết tủa D là CaCO3. Dung dịch D là Ca(HCO3)2. E là dung dịch FeCl2. F là Fe(OH)2 và G là Fe2O3
Bạn tự viết phản ứng nha ![]()
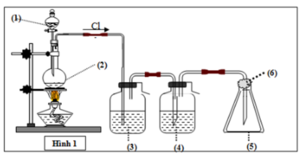

Để tránh Cl2 thoát ra ngoài không khí, người ta tẩm NaOH vào (6). Vì Cl2 có phản ứng với NaOH do đó bị giữ lại
PTPƯ
Đáp án: B