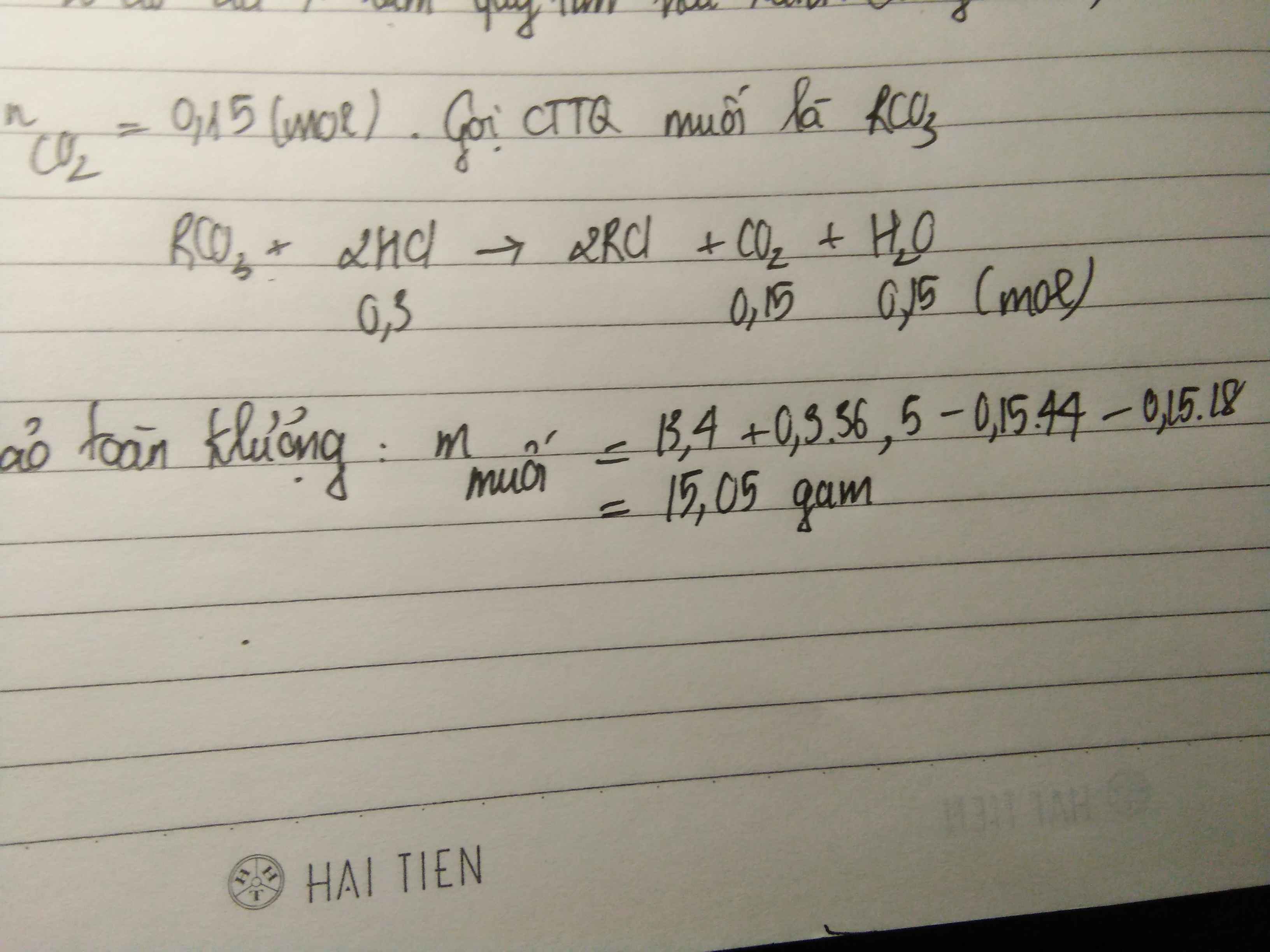Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng muối khan khi cô cạn là: 15,05 (g)
(mình cho kết quả thôi nha bạn)

23.8g MCO3+2HCL=>CO2 +MCL2 +H2O
nCO2=0.2mol
mMCL2=mM+mCL=23.8+0.2*2*35.5-0.2*44=29.2g
nCO2=4,48/22,4=0,2mol.
gọi muối 1 là A=)ct muối :A2CO3
------------2 là B=) ct muối :BCO3.
gọi mol muối 1 là x muối 2 là y
htan=hcl ta được:
A2CO3 + 2HCL==>2ACL+CO2+H2O
x => 2x => 2x => x =>x
BCO3 + 2HCL ==> BCL2 + CO2 + H2O
y => 2y => y => y => y
ta nhận thấy mol hỗn hợp 2 muối ban đầu bằng mol khí co2 thoát ra bằng mol h2o thu được.
mà mol co2 là 0,2 mol (1) => mol hỗn hợp muối cacbobat=0,2; mol h20=0,2mol.
có mol hcl = 2x+2y=2.(x+y)=2.0,2=0,4mol
theo ĐLBTKL ta có:
mhh+ mhcl= m muối mới( cần tìm)+m CO2 +m H2O
m muối mới= 23,8+ 0,4.36,5-0,2.44-0,2.18=26g
vậy kl muối là 26g . sai thì đừng ném gạch nhau

\(n_{CO_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(\Rightarrow n_{H_2O}=0.3\left(mol\right)\)
\(\Rightarrow n_{HCl}=0.3\cdot2=0.6\left(mol\right)\)
Bảo toàn khối lượng :
\(m_{Muối}=30.6+0.6\cdot36.5-0.3\cdot44-0.3\cdot18=6.9\left(g\right)\)
\(b.\)
\(n_{A_2CO_3}=a\left(mol\right),n_{BCO_3}=2a\left(mol\right)\)
\(n_{CO_2}=a+2a=0.3\left(mol\right)\)\(\Rightarrow a=0.1\left(mol\right)\)
\(m_{hh}=0.1\cdot\left(2A+60\right)+0.2\cdot\left(B+60\right)=30.6\left(g\right)\)
\(\Rightarrow A+B=63\)
\(A=23,B=40\)
\(CT:Na_2CO_3,CaCO_3\)

nCO2=\(\dfrac{6,72}{22,4}\)=0.3(mol)
⇒nH2O=0.3(mol)
⇒nHCl=0.3⋅2=0.6(mol)
Bảo toàn khối lượng :
mMuối=30.6+0.6⋅36.5−0.3⋅44−0.3⋅18=6.9(g)
b.b.
nA2CO3=a(mol),nBCO3=2a(mol)
nCO2=a+2a=0.3(mol)⇒a=0.1(mol)
mhh=0.1⋅(2A+60)+0.2⋅(B+60)=30.6(g)
⇒A+B=63
A=23,B=40
CT:Na2CO3,CaCO3

RO+H2SO4→ RSO4+H2ORO+H2SO4→ RSO4+H2O (1)
RCO3+H2SO4→ RSO4+CO2+H2ORCO3+H2SO4→ RSO4+CO2+H2O (2)
Đặt a là khối lượng hỗn hợp X.
x,y là số mol RO và RCO3RCO3
Ta có : (R+16)x+(R+60)y=a(R+16)x+(R+60)y=a (*)
Từ (1) và (2) \Rightarrow (R+96)(x+y)=1,68a (**)
Từ (2) \Rightarrow y=0,01a (***)
Giải (*),(**) và (***) \Rightarrow x=0,004a : R=24
Vậy R là Mg

a) \(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
=> nHCl = 0,27 (mol)
Theo ĐLBTKL: mkim loại + mHCl = mmuối + mH2
=> mmuối = 5,85 + 0,27.36,5 - 0,135.2 = 15,435 (g)
b) VH2 = 3,024 (l) (Theo đề bài)
c)
Hỗn hợp kim loại gồm \(\left\{{}\begin{matrix}Al:a\left(mol\right)\\X:3a\left(mol\right)\end{matrix}\right.\)
=> 27a + MX.3a = 5,85
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
X + 2HCl --> XCl2 + H2
3a------------------->3a
=> 1,5a + 3a = 0,135
=> a = 0,03 (mol)
=> MX = 56 (g/mol)
=> X là Fe

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{H_2\left(tổng\right)}=n_{Fe}+n_{Zn}=0,2+0,2=0,4\left(mol\right)\\ n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right);n_{FeCl_2}=n_{Fe}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,4.22,4=8,96\left(l\right)\\ m_{ZnCl_2}=0,2.136=27,2\left(g\right)\\ m_{FeCl_2}=127.0,2=25,4\left(g\right)\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: \(n_{HCl}=0,5.0,2=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{HCl\left(pư\right)}=2n_{H_2}=0,08\left(mol\right)< 0,1\left(mol\right)\)
→ HCl dư.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{H_2}=n_{Zn}+n_{Fe}=x+y=0,04\left(1\right)\)
\(\left\{{}\begin{matrix}n_{ZnCl_2}=n_{Zn}=x\left(mol\right)\\n_{FeCl_2}=n_{Fe}=y\left(mol\right)\end{matrix}\right.\)⇒ 136x + 127y = 5,26 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,02\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,02.65}{0,02.65+0,02.56}.100\%\approx53,72\%\\\%m_{Fe}\approx46,28\%\end{matrix}\right.\)