Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fr thuộc chu kì 7, đứng cuối nhóm IA. Vì vậy đây là một nguyên tố kim loại, mức độ hoạt động hóa học mạnh (có tính khử mạnh nhất).

- Để so sánh được xu hướng biến đổi một số tính chất của các nguyên tố, ta cần nắm được: Theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Độ âm điện: tăng dần trong một chu kì, giảm dần trong một nhóm A.
+ Tính kim loại: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Tính phi kim: tăng dần trong một chu kì, giảm dần trong một nhóm A.
- Giải thích:
+ Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng do lực hút giảm.
+ Độ âm điện phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng.
+ Tính kim loại và phi kim phụ thuộc vào bán kính và lực hút giữa hạt nhân với các electron lớp ngoài cùng.

Đáp án A.
Gọi M là nguyên tử khối trung bình của 2 kim loại A và B
Khi đó công thức oxit chung là ![]()
Ta có phản ứng
![]()
0,03 0,18
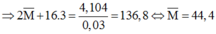
Suy ra phải có 1 kim loại có nguyên tử khối bé hơn 44,4 và 1 kim loại có nguyên tử khối lớn hơn 44,4
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối nhỏ hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Al (A = 27; Z = 13)
Kim loại còn lại có số hiệu nguyên tử bằng (A = 56)
Tổng số khối khi đó là 27 + 56 = 83
+ Nếu kim loại thuộc nhóm IIIA có nguyên tử khối lớn hơn 44,4 và thuộc chu kì 3 hoặc 4 thì chỉ có thể là Ga (A = 70; Z = 31)
Kim loại còn lại có số hiệu nguyên tử:


a) Fr là kim loại mạnh nhất. F là phi kim mạnh nhất.
b) Các kim loại được phâ bố ở khu vực bên trái trong bảng tuần hoàn.
c) Các phi kim được phân bố ở khu vực bên phải trong bảng tuần hoàn.
d) Nhóm IA gồm những kim loại mạnh nhất. Nhóm VIIA gồm những phi kim mạnh nhất.
e) Các khí hiếm nằm ở nhóm VIIIA ở khu vực bên phải trong bảng tuần hoàn.

- Ta có: O và F đều là phi kim => Xu hướng cơ bản của nguyên tử O và F trong phản ứng hóa học là nhận electron
- Cấu hình electron O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron
- Cấu hình electron F (Z = 9): 1s22s22p5=> Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron

Cấu hình electron của nguyên tử Mg: 1s22s22p63s2.
Mg có 2e ở lớp ngoài cùng nên thể hiện tính kim loại, hóa trị cao nhất với oxi là II, chất MgO là oxit bazơ và Mg(OH)2 là bazơ.

- Để xác định được vị trí các nguyên tố hóa học trong bảng tuần hoàn cần biết:
+ Số electron của nguyên tử ⇒ xác định được ô nguyên tố.
+ Số lớp electron của nguyên tử ⇒ xác định được chu kì.
+ Số electron hóa trị ⇒ xác định được nhóm.
- Phân loại thành phần nguyên tố: các nguyên tố s, p, d, f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s, p, d, f tương ứng.
- Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
+ Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
+ Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
+ Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim

- Các kim loại nhóm IA: Khả năng phản ứng với nước của các kim loại không giống nhau, khả năng phản ứng với nước giảm dần
- Dựa vào bảng tuần hoàn các nguyên tố hóa học, ta có thể giải thích được xu hướng biến đổi tính chất hóa học cơ bản của nguyên tử các nguyên tố