Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nCO=0,04(mol)
Ta có:
nO=nCO=0,04(mol)
=>m=1,68+16.0,04=2,32(g)

\(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,04 <----------------------- 0,04
\(\rightarrow m_{Cu}=2,88-0,04.56=0,64\left(g\right)\\\rightarrow n_{Cu}=\dfrac{0,64}{64}=0,01\left(mol\right)\)
\(m_{giảm}=m_{O\left(oxit\right)}=4-2,88=1,12\left(g\right)\\ \rightarrow n_O=\dfrac{1,12}{16}=0,07\left(mol\right)\)
\(\rightarrow n_{O\left(Fe_xO_y\right)}=0,07-0,01.1=0,06\left(mol\right)\)
CTHH FexOy
=> x : y = 0,04 : 0,06 = 2 : 3
CTHH Fe2O3
\(n_{CuO}=\dfrac{4}{80}=0,05mol\)
\(CuO+CO\underrightarrow{t^o}Cu+CO_2\)
\(Fe_xO_y+yCO\underrightarrow{t^o}xFe+yCO_2\)
Chất rắn sau phản ứng thu đc cho tác dụng với HCl chỉ có Fe tác dụng.
\(n_{H_2}=\dfrac{0,896}{22,4}=0,04mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,04 0,08 0,04 0,04
\(m_{Cu}=2,88-0,04\cdot56=0,64g\Rightarrow n_{CuO}=n_{Cu}=0,01mol\)
\(\Rightarrow m_{Fe_xO_y}=4-0,01\cdot80=3,2g\)
\(n_{Fe_xO_y}=\dfrac{1}{x}n_{Fe}=\dfrac{0,04}{x}\)
\(M=\dfrac{3,2}{\dfrac{0,04}{x}}=80x\)
Nhận thấy \(x=2\Rightarrow Fe_2O_3\)

Ta có: \(n_{H_2}=\dfrac{7,392}{22,4}=0,33\left(mol\right)\)
Gọi: nH2 (pư) = a (mol) ⇒ nH2 (dư) = 10%a (mol)
⇒ a + 10%a = 0,33
⇒ a = 0,3 (mol)
Có: \(H_2+O_{\left(trongoxit\right)}\rightarrow H_2O\)
⇒ nO (trong oxit) = 0,3 (mol)
\(\Rightarrow n_{Fe}=\dfrac{16-m_{O\left(trongoxit\right)}}{56}=0,2\left(mol\right)\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{0,2}{0,3}=\dfrac{2}{3}\)
Vậy: CTHH cần tìm là Fe2O3.

Bài 1:
Gọi kim loại cần tìm là R
2R + 2nHCl → 2RCln + nH2↑
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{n}n_{H_2}=\dfrac{2}{n}\times0,1=\dfrac{0,2}{n}\left(mol\right)\)
Ta có: \(M_R=2,4\div\dfrac{0,2}{n}\)
\(\Leftrightarrow M_R=12n\)
Lập bảng
| n | 1 | 2 | 3 |
| MR | 12 | 24 | 36 |
| loại | Mg | loại |
Vậy R là kim loại Mg

1.\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{8,96}{22,4}=0,4mol\)
\(Fe_xO_y+yH_2\rightarrow\left(t^o\right)xFe+yH_2O\)
\(\Rightarrow n_{H_2}=n_{H_2O}=0,4mol\)
\(m_{H_2}=n.M=0,4.2=0,8g\)
\(m_{H_2O}=n.M=0,4.18=7,2g\)
Định luật BTKL:
\(m_{Fe_xO_y}+m_{H_2}=m_{Fe}+m_{H_2O}\)
\(\Rightarrow m_{Fe}=16,8g\)
\(n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2}=0,4mol\)
\(n_{Fe\left(trong.oxit\right)}=n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(x:y=0,3:0,4=3:4\)
Vậy \(CTHH:Fe_3O_4\)
2.
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{5,6}{22,4}=0,25mol\)
\(4M+O_2\rightarrow\left(t^o\right)2M_2O\)
1 0,25 0,5 ( mol )
\(m_{O_2}=n.M=0,25.32=8g\)
Định luật BTKL:
\(m_M+m_{O_2}=m_{M_2O}\)
\(\Rightarrow m_M=39g\)
\(M_M=\dfrac{m}{n}=\dfrac{39}{1}=39\) ( g/mol )
\(\Rightarrow M:Kali\left(K\right)\)

a) FexOy+yCO→xFe+yCO2
b) +) Quy đổi 8g oxit sắt thành 8g (Fe; O). Khi đó, xảy ra phản ứng với CO
CO + O 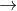 CO2
CO2
=> nCO (phản ứng) = nCO2
+) Lại có: M khí sau phản ứng = 2.d khí/H2 = 40 (g) ≠ MCO2
=> CO còn dư và O phản ứng hết
=> n hh sau = nCO ban đầu =  = 0,2 (mol)
= 0,2 (mol)
=> ∆m = m hh sau – mCO bđ = m Oxi (hh rắn) = 40.0,2 – 28.0,2 = 2,4 (g)
=> nCO2 = nO = 0,15 (mol)
=> mFe = 8 – 2,4 = 5,6 (g)
=> nFe = 0,1 (mol) ; nO = 0,15 (mol)
=> nFe : nO = 2 :3
=> CTPT oxit sắt là Fe2O3
Mặt khác, %V CO2/hh khí sau phản ứng = 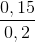 . 100% = 75%
. 100% = 75%
a)FexOy+yCO→xFe+yCO2
b)+) Quy đổi 8g oxit sắt thành 8g (Fe; O). Khi đó, xảy ra phản ứng với CO
CO + O 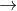 CO2
CO2
=> nCO (phản ứng) = nCO2
+) Lại có: M khí sau phản ứng = 2.d khí/H2 = 40 (g) ≠ MCO2
=> CO còn dư và O phản ứng hết
=> n hh sau = nCO ban đầu =  = 0,2 (mol)
= 0,2 (mol)
=> ∆m = m hh sau – mCO bđ = m Oxi (hh rắn) = 40.0,2 – 28.0,2 = 2,4 (g)
=> nCO2 = nO = 0,15 (mol)
=> mFe = 8 – 2,4 = 5,6 (g)
=> nFe = 0,1 (mol) ; nO = 0,15 (mol)
=> nFe : nO = 2 :3
=> CTPT oxit sắt là Fe2O3
Mặt khác, %V CO2/hh khí sau phản ứng = 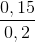 . 100% = 75%
. 100% = 75%

\(Fe_xO_y + yCO \xrightarrow{t^o} xFe + yCO_2\\ n_{CO} = \dfrac{4,48}{22,4} = 0,2(mol)\\ n_{CO\ pư} = a ; n_{CO\ dư} = b\\ \Rightarrow a + b = 0,2(1)\\ n_{CO_2} = a(mol)\\ m_X = 44a + 28b = (a + b).2.20 = 0,2.2.20 = 8(2)\\ (1)(2)\Rightarrow a = 0,15 ; b = 0,05\\ \%V_{CO_2} = \dfrac{0,15}{0,2}.100\% = 75\%\\ n_{Oxit} = \dfrac{n_{CO_2}}{y}=\dfrac{0,15}{y}(mol)\\ \)
\(\Rightarrow \dfrac{0,15}{y}(56x + 16y) = 8\\ \Rightarrow \dfrac{x}{y} = \dfrac{2}{3}\)
Vậy oxit là Fe2O3

\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\\ n_O=\dfrac{11,6-0,15}{16}=0,2\left(mol\right)\)
CTHH: FexOy
\(\rightarrow x:y=n_{Fe}:n_O=0,15:0,2=3:4\)
CTHH: Fe3O4
PTHH: Fe3O4 + 4H2 --to--> 3Fe + 4H2O
0,2 0,15
=> VH2 = 0,2.22,4 = 4,48 (l)
\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(n_{Fe_xO_y}=\dfrac{11,6}{56x+16y}\) mol
\(Fe_xO_y+yH_2\rightarrow\left(t^p\right)xFe+yH_2O\)
\(\dfrac{11,6}{56x+16y}\) \(\dfrac{11,6x}{56x+16y}\) ( mol )
\(\Rightarrow\dfrac{11,6x}{56x+16y}=0,15\)
\(\Leftrightarrow11,6x=8,4x+2,4y\)
\(\Leftrightarrow3,2x=2,4y\)
\(\Leftrightarrow4x=3y\)
\(\Leftrightarrow x=3;y=4\)
\(\Rightarrow CTHH:Fe_3O_4\)
\(\Rightarrow n_{H_2}=0,15.4:3=0,2mol\)
\(V_{H_2}=0,2.22,4=4,48l\)
PTHH: FexOy + yCO =(nhiệt)=> xFe + yCO2
Ta có: nFexOy = \(\frac{2,32}{56x+16y}\left(mol\right)\)
nCO2 = \(\frac{0,896}{22,4}=0,04\left(mol\right)\)
\(\Rightarrow n_{FexOy}=\frac{0,04}{y}\left(mol\right)\)
\(\Rightarrow\frac{2,32}{56x+16y}=\frac{0,04}{y}\)
Giải ra, ta được \(\frac{x}{y}=\frac{3}{4}\)
=> CTHH : Fe3O4
thanks