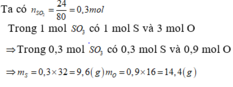Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có
M\(_X=\)2,5.32=80
Gọi CTDC: SxOy
Ta có tỉ lệ
\(\frac{32x}{40}=\frac{16y}{60}=\frac{80}{100}\)
=>x=1,y=3
CTHH:SO3
b) Ta có
n\(_{SO3}=\frac{24}{80}=0,3\left(mol\right)\)
Trong 1 mol SO3 có 1 mol S và 3 mol O
=> Trong 0,3 mol SO3 có 0,3 mol S và 0,9 mol O
=> m\(_S\)=0,3.32=9,6(g)
m\(_O=\)0,9.16=14,4 (g)
Chu8cs bạn học tốt

a) nNa2O = \(\dfrac{31}{62}=0,5\left(mol\right)\)
mdd NaOH = 1,25 . 200 = 250 (g)
Pt: Na2O + H2O --> 2NaOH
....0,5 mol-----------> 1 mol
mNaOH = 1 . 40 = 40 (g)
C% dd NaOH = \(\dfrac{40}{250}.100\%=16\%\)
CM NaOH = \(\dfrac{1}{0,2}=5M\)
P/s: câu b đề thiếu

Số mol của chất có trong hợp chất X
\(n_S=\frac{\%_S.M_X}{M_S}=\frac{40\%.24}{32}=0,3mol\)
\(n_O=\frac{\%_O.M_X}{M_O}=\frac{60\%.24}{16}=0,9mol\)
Tỉ lệ \(\frac{n_S}{n_O}=\frac{0,3}{0,9}=\frac{1}{3}\)
\(\rightarrow\hept{\begin{cases}x=1\\y=3\end{cases}}\)
Vậy hợp chất X có CTHH: \(SO_3\)
\(n_S=\frac{\%_S\cdot M_X}{M_S}=\frac{40\%\cdot24}{32}=0,3mol\)
\(n_O=\frac{\%_0\cdot M_X}{M_O}=\frac{60\%\cdot24}{16}=0,9mol\)
Tỉ lệ:\(\frac{n_S}{n_O}=\frac{0,3}{0,9}=\frac{1}{3}\)
\(\Rightarrow\hept{\begin{cases}x=1\\y=3\end{cases}}\)
Vậy hợp chất X có CTHH:\(SO_3\)

bài 2
số mol S và O là :
\(n_s=\frac{24}{32}=0,75\left(mol\right)\)
\(n_{O_2}=\frac{26}{16.2}=0,8125\left(mol\right)\)
pthh \(S+O_2\rightarrow SO_2\)
\(\frac{n_s\left(đề\right)}{n_s\left(pt\right)}=\frac{0,75}{1}< \frac{n_{O_2}\left(đề\right)}{n_{O_2}\left(pt\right)}=0,8125\)
=>tính theo S=>O dư =>S p/ứng hết
chất tạo thành là SO2
\(m_{SO_2}=n_{SO_2}.M_{SO_2}=0,75.\left(32+16.2\right)=48\left(g\right)\)
bài 3
số mol Fe và O là :
\(n_{Fe}=\frac{22,4}{56}=0,4\left(mol\right)\)
\(n_{O_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
pthh \(3Fe+2O_2\rightarrow Fe_3O_4\)
\(\frac{n_{Fe}\left(đề\right)}{n_{Fe}\left(pt\right)}=\frac{0,4}{3}>\frac{n_{O_2}\left(đề\right)}{n_{O_2}\left(pt\right)}=\frac{0,1}{2}\)
=>tính theo O=>Fe dư =>O p/ứng hết
chất tạo thành là Fe3O4
\(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,05.\left(56.3+16.4\right)=11.6\left(g\right)\)
Bài 2:
\(n_S=\frac{24}{32}=0,75\left(mol\right)\)
\(n_{O2}=\frac{26}{32}=0,8125\left(mol\right)\)
\(S+O_2\underrightarrow{t^O}SO_2\)
Ban đầu: 0,75_0,8125
Phản ứng: 0,75______0,75 (mol)
Dư: 0,0625
So sánh: \(\frac{0,75}{1}< \frac{0,8125}{1}\)
1. O2 dư
\(m_{O2\left(dư\right)}=0,0625.32=2\left(g\right)\)
2. Chất tạo thành là SO2
\(m_{SO_2}=0,75.64=48\left(g\right)\)
Bài 3:
\(n_{Fe}=\frac{22,4}{56}=0,4\left(mol\right)\)
\(n_{O_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
_________\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ban đầu: 0,4____0,1
Phản ứng: 0,15___0,1____0,05(mol)
Dư: 0,25
So sánh: \(\frac{0,4}{3}>\frac{0,1}{2}\)
1. Fe dư
\(m_{Fe\left(dư\right)}=0,25.56=14\left(g\right)\)
2. Fe3O4
\(m_{Fe3O4}=0,05.232=11,6\left(g\right)\)