Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong hỗn hợp Y: Đặt
![]()
Vì SO2 dư nên kết tủa Z gồm BaSO4 và BaSO3
Ta có:
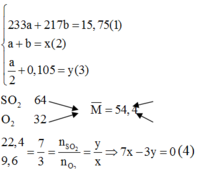


Nung nóng 30,005g hỗn hợp X gồm KMnO4, KClO3 và MnO2, sau 1 thời gian thu được khí O2 và nung nóng 24,405g chất rắn Y gồm K2MnO4, KCl. Để tác dụng hết với hh Y cần vừa đủ dd chứa 0,8 mol HCl, thu đc 4,844 lít khí Cl2 ở đktc. Tính thành phần % khối lượng KM
Sơ đồ quá trình phản ứng:
Theo bảo toàn khối lượng: mO2= 30,005 – 24,405 = 5,6 (g); ⇒ no2= 0,175 mol;
Bảo toàn e: 5x + 6y + 2z = 0,175×4 + 0,21625×2 = 1,1325;
Bảo toàn H: nH2O= 1/2nHCl = 0,4 mol;
Bảo toàn O: 4x + 3y + 2z = 0,175×2 + 0,4 = 0,75;
Theo bài ra ta có hệ pt: ⎧⎪⎨⎪⎩158x+122,5y+87z=30,0055x+6y+2z=1,13254x+3y+2z=0,75⇔⎧⎪⎨⎪⎩x=0,12y=0,0875z=0,00375{158x+122,5y+87z=30,0055x+6y+2z=1,13254x+3y+2z=0,75⇔{x=0,12y=0,0875z=0,00375
Ta thấy: 0,0875 mol KClO3 bị nhiệt phân hoàn toàn sinh 0,13125 mol O2
⇒ còn 0,04375 mol O2 nữa là do 0,0875 mol KMnO4;
⇒ %(KMnO4 đã bị nhiệt phân) = 0,08750,120,08750,12×100% = 72,92% nO4 bị nhiệt phân

nO2 = 6.72/22.4 = 0.3 (mol)
BTKL :
mKMnO4 = 116.8 + 0.3*32 = 126.4 (g)
nKMnO4 = 126.4/158 = 0.8 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.6_________________________0.3
H% = 0.6/0.8 * 100% = 75%

Đáp án D
Chọn 1 mol hỗn hợp X ban đầu thì
![]()
Theo quy tắc đường chéo hoặc giải hệ ta dễ dàng xác định được trong X có
![]()
Xét cân bằng ![]()
Mol ban đầu 0,75 0,25
Mol phản ứng 2x x 2x
Mol cân bằng (0,75 – 2x) (0,25 – x) 2x
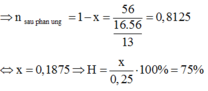

a) Dùng không khí nén có nồng độ oxi cao và không khí đã nóng sẵn thổi vào lò cao nên tốc độ phản ứng tăng.
b) Lợi dụng yếu tố nhiệt độ (tăng nhiệt độ)
c) Lợi dụng yếu tố diện tích tiếp xúc (tăng diện tích tiếp xúc của nguyên liệu)



\(2HgO-->2Hg+O2\)
\(n_{HgO}=\frac{21,7}{217}=0,1\left(mol\right)\)
\(n_{O2}=\frac{1}{2}n_{HgO}=0,05\left(mol\right)\)
\(m_{O2}=0,05.32=1,6\left(g\right)\)
\(H\%=\frac{1,28}{1,6}.100\%=80\%\)