Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bạn xem câu trả lời của mình nhà :
Tỉ số về khối lượng của electron so với proton
Tỉ số về khối lượng của electron với nơtron

TL
Hợp chất M được tạo từ 3 nguyên tố X, Y, Z. M có tổng số điện tích hạt nhân là 32, hiệu điện tích hạt nhân Z, Y là 1. Tổng số electron trong ion ZY3- là 32. Công thức phân tử của M là:
A. HNO3 B. HNO2 C. NaNO3 D. H3PO4
HT(MK NGHĨ VẬY THÔI)
Hợp chất M được tạo từ 3 nguyên tố X, Y, Z. M có tổng số điện tích hạt nhân là 32, hiệu điện tích hạt nhân Z, Y là 1. Tổng số electron trong ion ZY3- là 32. Công thức phân tử của M là:
A. HNO3 B. HNO2 C. NaNO3 D. H3PO4

Những phản ứng sau là phản ứng oxi hóa khử:
.jpg)
.png)
Cl2 vừa là chất khử vừa là chất oxi hóa.
b) .png) + 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
+ 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
CaOCl2: phân tử tự oxi hóa khử, HCl đóng vai trò môi trường
.jpg)
.png) Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
.jpg)
.png)
HCl là chất khử, KClO3 là chất oxi hóa
.jpg)

CaOCl2: phân tử tự oxi hóa
.jpg)
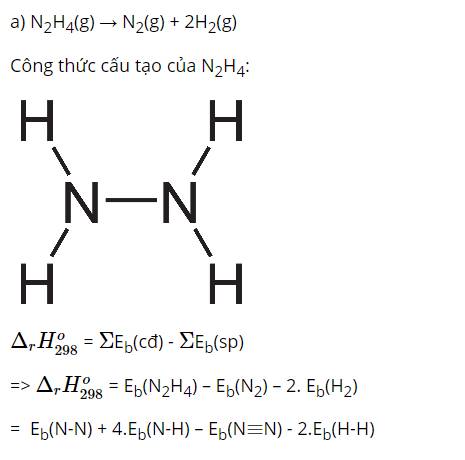
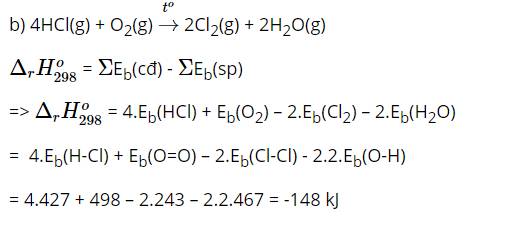

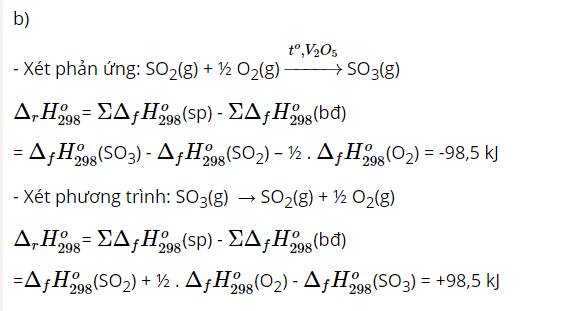
Áp dụng định luật tác dụng khối lượng: v = kCH2.CI2
=> Ở một nhiệt độ không đổi, tốc độ phản ứng (6) tỉ lệ thuận với nồng độ của H2 cũng như nồng độ của I2
=> Nếu nồng độ của H2 và I2 tăng gấp đôi thì tốc độ phản ứng (6) tăng lên 4 lần