Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nCu = 48/64 = 0.75 (mol)
2R + 6HCl => 2RCl3 + 3H2
0.5__1.5_______0.5____0.75
MR = 13.5/0.5 = 27
R là : Al
VH2 = 0.75 * 22.4 = 16.8 (l)
mAlCl3 = 0.5*133.5 = 66.75 (g)
mHCl = 1.5*36.5 = 54.75 (g)
cho mình hỏi dữ liệt này thế nào ạ
Dẫn toàn bộ khí sinh ra đi qua bột CuO vừa đủ nung nóng thì được 48g chất rắn

\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\\ a,PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\ b,Theo.PTHH:n_{H_2}=n_{Mg}=0,3\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=0,3\cdot22,4=6,72\left(l\right)\)
Ta có sau p/ứ muối tạo thành là \(MgCl_2\)
Do đó \(m=m_{MgCl_2}=0,3\cdot95=28,5\left(g\right)\)

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
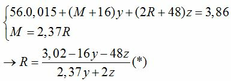
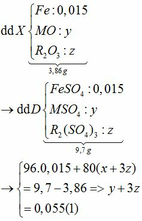
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

a) CTHH: R2O3
\(m_{H_2SO_4}=\dfrac{294.20}{100}=58,8\left(g\right)=>n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
PTHH: R2O3 + 3H2SO4 --> R2(SO4)3 + 3H2O
_______0,2<------0,6---------->0,2_________________(mol)
=> \(M_{R_2O_3}=\dfrac{32}{0,2}=160\left(g/mol\right)=>M_R=56\left(Fe\right)\)
b) \(m_{Fe_2\left(SO_4\right)_3}=0,2.400=80\left(g\right)\)

Gọi x là hóa trị của kim loại
Gỉa sử kim loại tham gia 1 mol => Ta có PTHH:
2R + xH2SO4 ---------> A2(SO4)x + xH2
1.........x\2.....................1\2.............x\2 (mol)
Ta có : mA = 1 . MA = A(g) ; mH2SO4= \(\frac{98x}{2}\) (g)
=> mddH2SO4 =\(\frac{\frac{98x}{2}.100}{9.8}\) = 500x (g)
=> mdd sau phản ứng = mH2SO4 + mA - mH2 = 500x + A - x (g)
=> mmuối sunfat= \(\frac{2A+96x}{2}\)(g)
Vậy nồng độ muối sau phản ứng là \(\frac{\frac{2A+96x}{2}}{500x+A-x}=\frac{15.14}{100}\)
=> A = \(\frac{2754.86}{84.86}\) x
Xét x = 1 thì A là 32.46358708 [ A là Lưu huỳnh (loại)]
x = 2 thì A là 64.92717417 [A là Zn ( nhận)]
x = 3 thì A là 97.39076125 (loại)
Vậy kim loại tham gia phản ứng là Kẽm (Zn)

gọi Cthuc Oxit X là M2On : Y là : M2Om
Ta có Pt; M2On + 2nHNO3-> 2M(NO3)n+ nH2O
M2On + 2nHCl2-> 2MCln+ nH2O
- Tự chọn lượng chất: Gọi số gam oxit X là (2M+16n)gam hay 1 mol
ta có 2(M+62n)-2(M+35,5n)= 99,38( 2M+16n)/100
Gia ra:
M=18,7n
biện luân với n= 1,2,3
Nhận n=3 =>M =56
Vậy X là Fe2O3
Từ Phân tử khối của oxit Y bằng 45% phân tử khối của oxit X
Suy ra nốt Y: FeO

Giả sử nNO2 = 3 mol và nH2 = 1 mol
TN1: Tác dụng với HNO3 đặc nóng
\(\text{n e = nNO2 = 3 mol}\)
Mà \(\text{nNO3-(muối KL) = n e = nNO2 = 3 mol}\)
\(\rightarrow\)m muối nitrat = mR + mNO3- = mR + 3.62 = mR + 186 (g)
TN2: Tác dụng với H2SO4 loãng
\(\text{n e = 2nH2 = 2 mol}\)
Mà \(\text{nSO4 2-(muối KL) = 0,5.n e = 1 mol}\)
=> m muối sunfat = mR + mSO4 2- = \(\text{mR + 1.96 = mR + 96 (g)}\)
Mà khối lượng muối sunfat bằng 62,8% khối lượng muối nitrat nên ta có:
\(m_R+96=\frac{62,8}{100}\left(mR+186\right)\rightarrow m_R=56\)
Giả sử hóa trị cao nhất của KL là n. Xét thí nghiệm 1:
Áp dụng bảo toàn e: n.nR = nNO2 → n.nR = 3 → nR = 3/n (mol)
→ MR = mR : nR = 56 : \(\frac{3}{n}\rightarrow M_R=\frac{56}{3}n\)
→ n = 3 và MR = 56 thỏa mãn
Vậy kim loại R là Fe