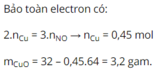Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Đặt:\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{matrix}\right.\\ Fe\rightarrow Fe^{3+}+3e\\ Cu\rightarrow Cu^{2+}+2e\\ 4H^++NO_3^-+3e\rightarrow NO+2H_2O\\ Bảotoàne:3x+2y=0,4.3\\ Tacó:56x+64y=30,4\\ \Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=36,84\%\\\%m_{Cu}=63,16\%\end{matrix}\right.\\ n_{HNO_3}=4n_{NO}=0,4.4=1,6\left(mol\right)\\ \Rightarrow V_{HNO_3}=\dfrac{1,6}{1}=1,6\left(l\right)\\ m_{muối}=m_{Fe\left(NO_3\right)_3}+m_{Cu\left(NO_3\right)_2}=0,2.242+0,3.188=104,8\left(g\right)\)

1.
a. nNO2=\(\frac{24,64}{22,4}\)=1,1mol
Al+6HNO3\(\rightarrow\)Al(NO3)3+3NO2+3H2O
Cu+4HNO3\(\rightarrow\)Cu(NO3)2+2NO2+2H2O
Gọi sô ml Al và Cu là a và b
Ta có 27a+64b=14,5(1)
Lại có nNO2=3nAl+2nNO2\(\rightarrow\)3a+2b=1,1(1)
Từ (1) và (2)
\(\left\{{}\begin{matrix}\text{ 27a+64b=14,5}\\\text{3a+2b=1,1}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,3\\b=0,1\end{matrix}\right.\)
\(\rightarrow\)%mAl=\(\frac{\text{0,3.27}}{14,5}\)=55,86%
\(\rightarrow\)%mCu=44,14%
b. Khối lượng muối:
mAl(NO3)3+mCu(NO3)2=0,3.213+0,1.188=82,7

a)
\(n_{NO} = 0,01(mol)\)
Bảo toàn electron : \(2n_{Cu} = 3n_{NO}\)
\(\Rightarrow n_{Cu} = 0,015(mol)\)
Vậy :
\(\%m_{Cu} = \dfrac{0,01.64}{1,98}.100\% = 32,32\%\\ \%m_{Al_2O_3} = 100\% - 32,32\% = 67,68\%\)
b)
\(n_{Al_2O_3} = \dfrac{1,98-0,015.64}{102} = 0,01(mol)\)
\(n_{OH^-} = n_{NaOH} + 2n_{Ba(OH)_2} = 0,1.1 + 0,5.0,1.2 = 0,2(mol)\)
Ta có :
\(n_{Cu(NO_3)_2} = n_{Cu} = 0,015(mol)\\ n_{Al(NO_3)_3} = 2n_{Al_2O_3} = 0,02(mol)\)
Mà : \(n_{OH^-} = 4n_{Al(NO_3)_3} + 2n_{Cu(NO_3)_2} + n_{HNO_3\ dư}\)
\(\Rightarrow n_{HNO_3\ dư} = 0,09(mol)\)
Bảo toàn nguyên tố với N :
\(n_{HNO_3\ pư} = 3n_{Al(NO_3)_3} + 2n_{Cu(NO_3)_2} = 0,06(mol)\)
Vậy, \(V = \dfrac{0,09 + 0,06}{1} = 0,15(lít)\)

Khí không màu hóa nâu trong không khí : NO
\(n_{NO} = \dfrac{2,987}{22,4}(mol)\)
Gọi \(n_{Fe} = a(mol) ; n_{Ag} = b(mol)\\ \Rightarrow 56a + 108b = 16,4(1)\)
Bảo toàn electron :\(3n_{Fe} + n_{Ag} = 3n_{NO}\)
\(\Rightarrow 3a + b = \dfrac{2,987}{22,4}.3(2)\)
Từ (1)(2) suy ra a = 0,1 ; b = 0,1
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,4}.100\% = 34,15\% \\\%m_{Ag} = 100\% - 34,15\% = 65,85\%\)

a)
$Fe + 4HNO_3 \to Fe(NO_3)_3 + NO + 2H_2O$
$Fe_2O_3 + 6HNO_3 \to 2Fe(NO_3)_3 + 3H_2O$
Theo PTHH : $n_{Fe} = n_{NO} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Fe} = \dfrac{0,15.56}{24,4}.100\% = 34,4\%$
$\%m_{Fe_2O_3} = 100\% - 34,4\% = 65,6\%$
b)
$n_{Fe_2O_3} = 0,1(mol)$
$n_{HMO_3} = 4n_{Fe} + 6n_{Fe_2O_3} = 1(mol)$
$\Rightarrow m_{dd\ HNO_3} = \dfrac{1.63}{10\%} = 630(gam)$