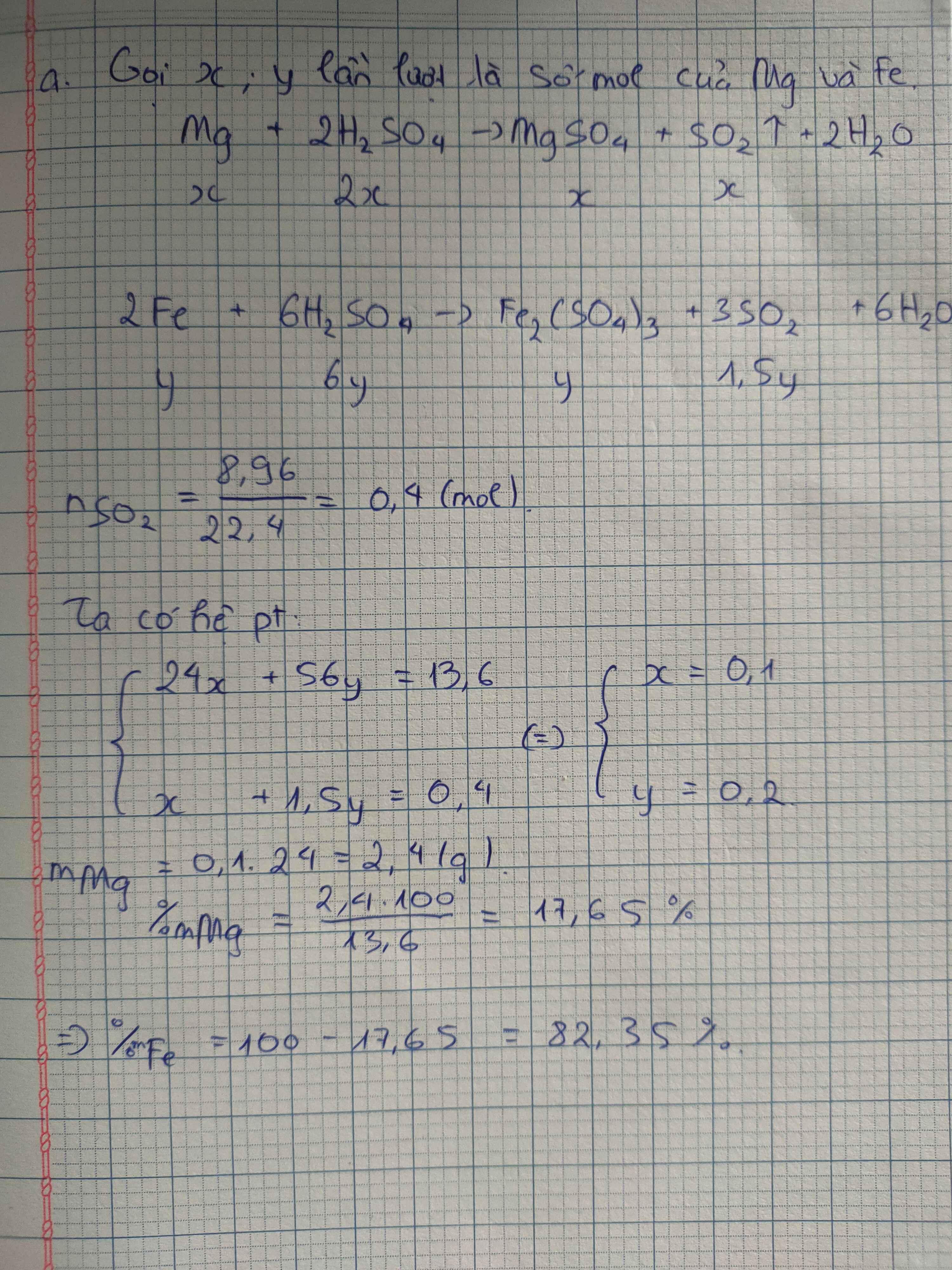Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Thấy Cu không phản ứng với HCl .
\(\Rightarrow m_{cr}=m_{Cu}=6,4\left(g\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
.x.......................................1,5x.........
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
.y....................................y.............
Theo bài ra ta có hệ : \(\left\{{}\begin{matrix}27x+56y+6,4=17,4\\1,5x+y=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\) ( mol )
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=5,4\\m_{Fe}=5,6\end{matrix}\right.\) ( g )
b, \(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
.......0,1.........0,2...............................
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
...0,2.......0,6..........................
\(\Rightarrow n_{NaOH}=0,2+0,6=0,8< 1\)
=> Trong B còn có HCl dư .
\(NaOH+HCl\rightarrow NaCl+H_2O\)
...0,2..........0,2....................
=> Dư 0,2 mol HCl .
\(\Rightarrow n_{HCl}=2n_{H_2}+0,2=1\left(mol\right)\)
\(\Rightarrow m_{ddB}=17,4+250-6,4-0,8=260,2\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,2.36,5}{260,2}.100\%\approx2,8\%\\C\%_{FeCl_2}\approx4,88\%\\C\%_{AlCl_3}\approx10,26\%\end{matrix}\right.\)
Vậy ....

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

a) n Fe = a(mol) ; n Cu = b(mol) ; n SO2 = 16/64 =0,25(mol)
56a + 64b = 12
Bảo toàn e : 3a + 2b = 0,25.2 = 0,5
Suy ra a =b = 0,1
%m Fe = 0,1.56/12 .100% =46,67%
%m Cu = 100% -46,67% = 53,33%
b)
Thiếu dữ kiện (thiếu nồng độ mol của KOH)
Theo gt ta có: $n_{SO_2}=0,25(mol)$
a, Gọi số mol Fe và Cu lần lượt là a;b(mol)
$\Rightarrow 56a+64b=12$
Bảo toàn e ta có: $3a+2b=0,5$
Giải hệ ta được $a=0,1;b=0,1$
Suy ra $\%m_{Fe}=46,67\%;\%m_{Cu}=53,33\%$
b, Ta có: $m_{dd}=94(g)$
$\Rightarrow \%C_{Fe_2(SO_4)_3}=21,27\%;\%C_{CuSO_4}=17,02\%$
Đề bạn thiếu nồng độ mol của KOH nên không tìm được lượng H2SO4 dư nhé!

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{H_2}=n_{Fe}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(m_{CuO}=35.2-0.2\cdot56=24\left(g\right)\)
\(n_{CuO}=\dfrac{24}{80}=0.3\left(mol\right)\)
\(\%Fe=\dfrac{11.2}{35.2}\cdot100\%=31.82\%\)
\(\%CuO=100-31.82=68.18\%\)
\(n_{H_2SO_4}=0.2+0.3=0.5\left(mol\right)\)
\(m_{H_2SO_4}=0.5\cdot98=49\left(g\right)\)
\(C\%H_2SO_4=\dfrac{49}{800}\cdot100\%=6.125\%\)
\(m_{FeSO_4}=0.2\cdot152=30.4\left(g\right)\)
\(m_{CuSO_4}=0.3\cdot160=48\left(g\right)\)

a) Gọi số mol Al, Zn là a, b (mol)
=> 27a + 65b = 11,9 (1)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----->1,5a----------------->1,5a
Zn + H2SO4 --> ZnSO4 + H2
b------>b------------------>b
=> 1,5a + b = 0,4 (2)
(1)(2) => a = 0,2 (mol); b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{11,9}.100\%=45,378\%\\\%m_{Zn}=\dfrac{0,1.65}{11,9}.100\%=54,622\%\end{matrix}\right.\)
b) nH2SO4 = 1,5a + b = 0,4 (mol)
=> mH2SO4 = 0,4.98 = 39,2 (g)
=> \(C\%_{dd.H_2SO_4}=\dfrac{39,2}{150}.100\%=26,133\%\)

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
0,2<-----0,3<-----------0,1-------------0,3
Cu + 2H2SO4 ---> CuSO4 + SO2 + 2H2O
0,1<---------------------------------0,1
\(\rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Cu}=0,1.64=6,4\left(g\right)\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{11,8}.100\%=45,76\%\\\%m_{Cu}=100\%-45,76\%=54,24\%\end{matrix}\right.\)
\(m_{ddA}=\dfrac{0,3.98}{20\%}+5,4-0,3.2=151,8\left(g\right)\\ C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{151,8}.100\%=22,53\%\)