Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) MA = 32.2 = 64(g/mol)
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
b) MA = 2.17 = 34 (g/mol)
\(m_H=\dfrac{34.5,88}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=34-2=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S

MX = 17.2 = 34 (g/mol)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_H=\dfrac{5,88.34}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
=> CTHH: H2S

a) Có 2R+(96x3)=342
Suy ra: R=27 là nhôm(Al)
b) MB=32x0,5=16
Suy ra: MA=16x2,125=34
Ta có : HuSv
5,88%=100u/34 =>u=2
94,12%=32 x 100 x v/34 => v=1
Vậy công thức hoá học của A là: H2S
Chúc bạn học tốt!

M(X)= 17.2= 34(g/mol)
Gọi CTTQ của X là HxSy (x,y: nguyên, dương)
mH= 34.5,88% \(\approx\) 2(g) -> x=nH=2/1=2
mS=34-2=32(g) ->y=nS=32/32=1
=> Với x=2;y=1 -> X là H2S

Gọi công thức dạng chung của hợp chất A cần tìm là HxSy(x,y:nguyên,dương)HxSy(x,y:nguyên,dương)
Theo đề bài, ta có: MA=MHxSy=1,172.29=34(gmol)MA=MHxSy=17.2=34(gmol)
Ta có: x:y=%mHMH:%mSMS=5,881:94,1232
Hãy tìm CTHH của hợp chất A có chứa 5.88%H và 94.12%S.Biết khí A có tỉ khối với không khí là 1.172
Gọi công thức dạng chung của hợp chất A cần tìm là HxSy(x,y:nguyên,dương)HxSy(x,y:nguyên,dương)
Theo đề bài, ta có: MA=MHxSy=1,172.29=34(gmol)MA=MHxSy=17.2=34(gmol)
Ta có: x:y=5,88\1 :94,12\32 =2:1=>x=2;y=1x:y=%mHMH:%mSMS=5,881:94,1232=2:1=>x=2;y=1
Vậy: CT dạng tối giản của hợp chất A là H2S.
CT thực nghiệm là (H2S)a (a: nguyên, dương)
<=>(2.1+32)a= 34=> a=1
=> CTHH của hợp chất A là H2S (axit sunfurhiđric).

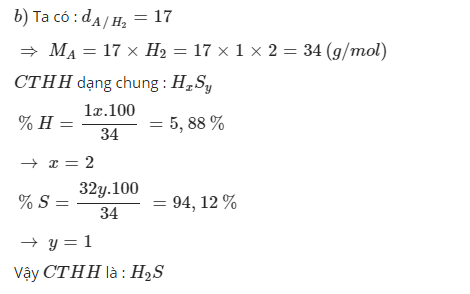
Sửa đề : Tỉ khối của f so với hidro là 17
M F = 2.17 = 34
Số nguyên tử Hidro = $\dfrac{34.5,88\%}{1} = 2$
Số nguyên tử Lưu huỳnh = $\dfrac{34 - 1.2}{32} = 1$
Vật F là $H_2S$
\(\%S=100-5.88=94.12\%\)
\(CT:H_xS_y\)
\(x:y=\dfrac{5.88}{1}:\dfrac{94.12}{32}=5.88:2.94=2:1\)
\(CT:\left(H_2S\right)_n\)
\(M_F=17\cdot2=34\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow34n=34\)
\(\Rightarrow n=1\)
\(CT:H_2S\)