Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có MFeClx= 56+ 35,5.x = 162,5
=> x= 3
Vậy CT của hợp chất là FeCl3

Gọi CTPT của A là FexOy
Ta có: \(\%Fe=\dfrac{56.x}{160}=40\Rightarrow x=2\)
\(\%O=\dfrac{16.y}{160}=40\Rightarrow y=3\)
Vậy CTPT của A là Fe2O3

\(PTK\left(MO_2\right)=44\left(dvC\right)\)
\(NTK\left(M\right)=44-16\cdot2=12\left(dvC\right)\)
=> M là cacbon

CTHH của hợp chất: \(XY_3\)
Ta có: \(\dfrac{m_X}{m_Y}=\dfrac{X}{3Y}=\dfrac{2}{3}\left(1\right)\)
Mặt khác: X+ 3Y=80 (2)
Từ (1), (2) => X=32 (Lưu huỳnh- S), Y=16 (Oxi- O)
=> CTHH của hợp chất: \(SO_3\)

1.\(a.CTHH:Fe_2\left(SO_4\right)_x\\ Tacó:56.2+\left(32+16.4\right).x=400\\ \Rightarrow x=3\\ VậyCTHH:Fe_2\left(SO_4\right)_3\\ b.CTHH:Fe_xO_3\\ Tacó:56.x+16.3=160\\ \Rightarrow x=2\\ VậyCTHH:Fe_2O_3\)
2. \(M_{Cu}=64\left(g/mol\right)\\ M_{H_2O}=2+16=18\left(g/mol\right)\\ M_{CO_2}=14+16.2=44\left(g/mol\right)\\ M_{CuO}=64+16=80\left(g/mol\right)\\ M_{HNO_3}=1+14+16.3=63\left(g/mol\right)\\ M_{CuSO_4}=64+32+16.4=160\left(g/mol\right)\\ M_{Al_2\left(SO_4\right)_3}=27.2+\left(32+16.4\right).3=342\left(g/mol\right)\)
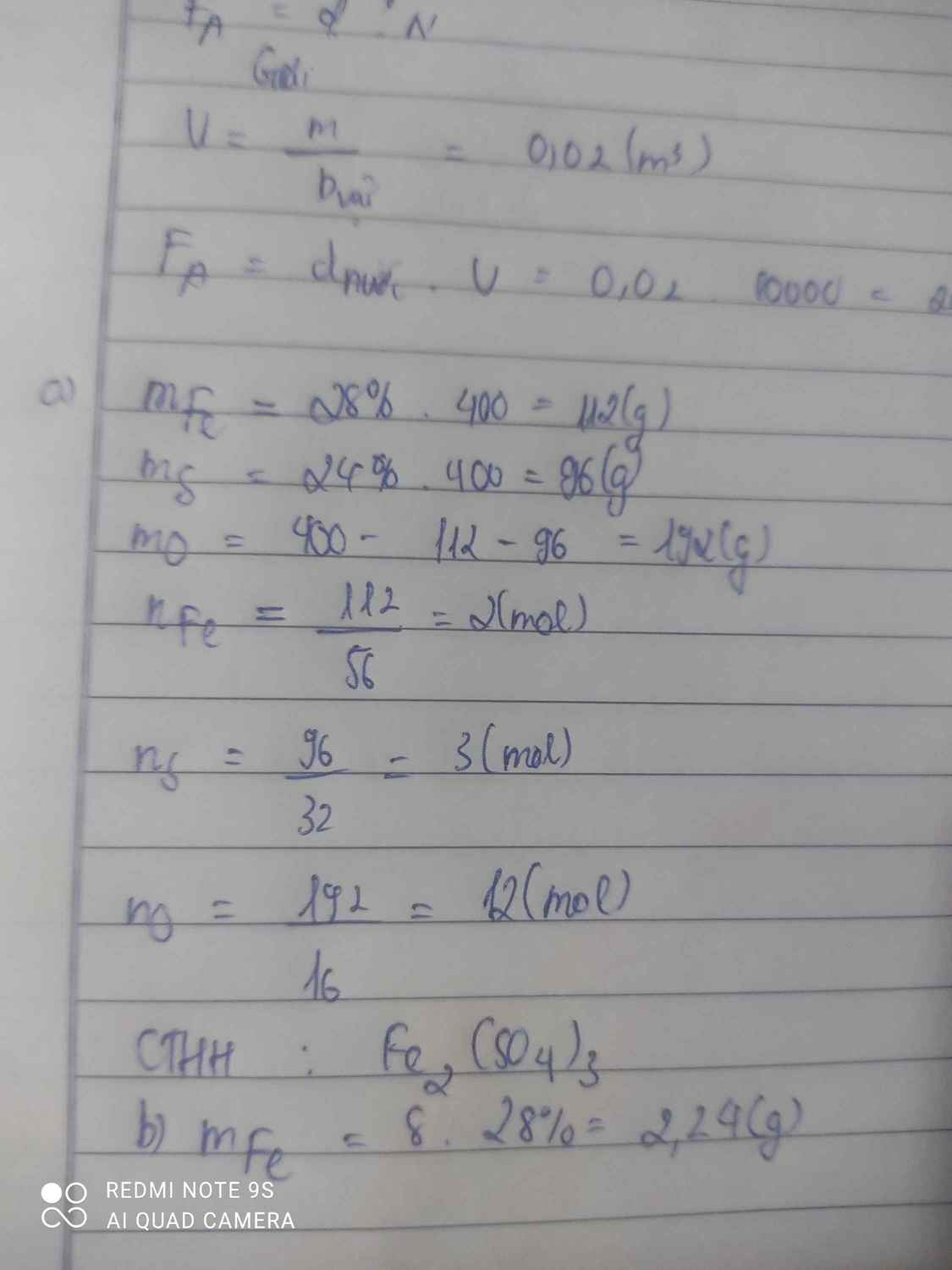
Sửa : $27 \to 127$
Ta có : $PTK = 2M + 16.3 = 160(đvC) \Rightarrow M = 56(Fe)$
Ta có : PTK của B $= M + 35,5n = 56 + 35,5n = 127 \Rightarrow n = 2$
Vậy M là Fe, CTPT của A là $FeCl_2$