Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Hỗn hợp ban đầu chứa N 2 : 0 , 2 H 2 : 0 , 8
→ Hiệu suất tính theo N2.
nsau = 3,6/4 = 0,9 → N2 phản ứng = 0,05 → H = 25%

Đáp án C
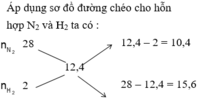
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có : n N 2 n H 2 = 2 3
=> H2 thiếu, hiệu suất phản ứng tính theo H2.
Chọn n N 2 = 2 m o l n H 2 = 3 m o l
nH2 pư = 3 . 40% = 1,2 mol,
n N2 phản ứng = 0,4 mol
n NH3 sinh ra =0,8 mol.
n Y = n X - 0 , 8 = 2 + 3 - 0 , 8 = 4 , 2 m o l
Bảo toàn khối lượng :
![]()
Vậy tỉ khối của Y với H2 là 7,38

Chọn C
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
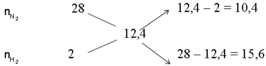
![]()
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn n N 2 = 2 n H 2 = 3
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên : n Y = n x − 0 , 8 = 2 + 3 − 0 , 8 = 4 , 2 mol
Theo định luật bảo toàn khối lượng ta có : m Y = m x = m N 2 + m H 2 = 2 . 28 + 3 . 2 = 62 gam
Vậy M ¯ Y = m Y n Y = 62 4 , 2 = 14 , 76

nBr2 = 0,05
Dẫn hỗn hợp Y qua dung dịch Br2 dư thấy khối lượng bình tăng 1,82 gam và có 8 gam brom đã tham gia phản ứng
⇒ nAnken/Y = nBr2 = 0,05 = nC2H4 dư + nC3H6 dư (1)
mAnken/Y = 1,82g
Vì Hiệu suất hidro hóa của 2 anken như nhau
⇒ nC2H4 phản ứng : nC2H4 ban đầu = nC3H6 phản ứng : nC3H6 ban đầu
⇒ nC2H4 dư : nC2H4 = nC3H6 dư : nC3H6
⇒ nC2H4 dư : 0,1 = nC3H6 dư : 0,15 (2)
Từ (1) và (2) ⇒ nC2H4 dư = 0,02 ; nC3H6 = 0,03
nC2H4 phản ứng = 0,1 – 0,02 = 0,08
⇒ H = (0,08 : 0,1).100% = 80%
Đáp án B.

\(M_X=12,4\)
Áp dụng phương pháp đường chéo:
12,4 H 2 (2) N 2 (28) 10,4 15,6
\(\frac{n_{N2}}{n_{H2}}=\frac{2}{3}\)
Có 2 mol N2 và 3 mol H2
\(n_{N2\left(tt\right)}=2.40\%=0,8\left(mol\right)\)
\(n_{H2\left(tt\right)}=3.40\%=1,2\left(mol\right)\)
\(PTHH:N_2+3H_2\rightarrow2NH_3\)
Ban đầu__0,8___1,2________
Phứng___0,4____1,2________
Sau_____0,4____0________0,8
\(\Rightarrow\overline{M_Y}=\frac{28.0,4+0,8.17}{1,2}=20,67\)

Đáp án B
Áp dụng phương pháp đường chéo cho hỗn hợp X:
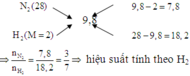
Cách 1: Gọi số mol N2 là 3x thì số mol H2 là 7x ⇒ tổng số mol hỗn hợp X là 3x + 7x = 10x
Thay vào công thức:
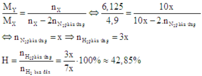
Cách 2: Áp dụng công thức tính nhanh với trường hợp x < 3y:
Hiệu suất phản ứng:
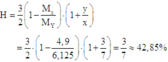

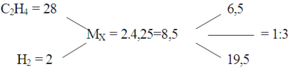
Giả sử nX = 4 ⇒ nC2H4 = 1 ; nH2 = 3
nC2H4 phản ứng = 1. 75% = 0,75
C2H4 + H2 → C2H6
0,75 → 0,75 0,75
nY = 4 – nH2 phản ứng = 4 – 0,75 = 3,25
mY = mX =28 + 3.2 = 34
⇒ MY = 34 : 3,25 = 10,46
⇒ dY/H2 = 5,23
Đáp án A.
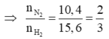

Gọi mol N2; H2 ban đầu là a, b
\(\overline{M_X}=3.2=6\)
\(\Rightarrow\frac{28a+2b}{a+b}=6\)
\(\Rightarrow22a=4b\)
\(\Rightarrow\frac{a}{b}=\frac{2}{11}\)
Giả sử a=2; b= 11
\(N_2+3H_2⇌2NH_3\)
Gọi x là mol N2 phản ứng => H2 phản ứng 3x mol. Tạo 2x mol NH3
=> Y chứa 2-x mol N2, 11-3x mol H2, 2x mol NH3
\(\Rightarrow\frac{28\left(2-x\right)+2\left(11-3x\right)+17.2x}{2-x+11-3x+2x}=8\)
\(\Rightarrow x=6,125\)
\(\Rightarrow H=\frac{1,625.100}{2}=81,25\%\)