

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 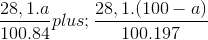 = 0,2
= 0,2
=> a = 29,89.

Định hướng tư duy giải
Dung dịch Z chứa
A l C l 3 : a H C l : a → B T N T H 4 , 25 a = a + 3 a + 0 , 09 → a = 0 , 36
→ B T N T A l A l 2 O 3 : 0 , 18 C u : 0 , 24 → B T e n N O 2 = 0 , 48 m o l

Đáp án : B
Dễ thấy trên đồ thị HCl dư
n HCl = a mol
=> Z chứa AlCl3 và HCl dư với cùng số mol
=> n AlCl3 = a mol => n Al2O3 = a/ 2
Chất rắn Y chứa Cu: 2a/ 3 (mol)
Al3+ + 3OH – → Al(OH)3
a 3a a
Al(OH)3 + OH – → Al(OH)4 –
0,09 0,09
=> 3a + 0,09 = 4,25a – a
<=> 0,25 a = 0,09 <=> a = 0,36 mol
=> n Cu = 0,24 mol
Cu + HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
0,24

Chọn đáp án D
Tại nNaOH = a thì có kết tủa → Lúc này vừa trung hòa hết HCl
→ 2 chất tan có cùng nồng độ mol là và HCl cùng số mol = a mol
Tại = 4,25a mol →kết tủa tan 1 phần
→ a – 0,09 = 4a – (4,25a – a)
→ a = 0,36 mol →nAl2O3 = 0,18 mol ; nCu = 0,24 mol
Y + : (bảo toàn e) = 0,48 mol = x

Đáp án A
Tại nNaOH = a thì có kết tủa => Lúc này vừa trung hòa hết HCl
=> 2 chất tan có cùng nồng độ mol là AlCl3 và HCl cùng số mol = a mol
Tại nNaOH = 4,25a mol => kết tủa tan 1 phần
=> nAl(OH)3 = 4nAl3+ - (nOH – nH+) => a – 0,09 = 4a – (4,25a – a)
=> a = 0,36 mol => nAl2O3 = 0,18 mol ; nCu = 0,24 mol
Y + HNO3 : nNO2 = 2nCu (bảo toàn e) = 0,48 mol = x
=>A

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O