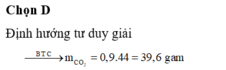K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

19 tháng 2 2020
nC=nCO2=1mol=>mCO2=44g
nH=2,8mol=>nH2O=1,4=>mH2O=25,2g

15 tháng 11 2016
Em moi hoc lop7 k the lam dc bai nay, nhung cj dat kl cua moi chat la x;y rồi viet pt hóa hoc, tim moi lien he x;y

16 tháng 11 2016
Na2CO3 + H2SO4 → Na2CO3 +CO2 +H2O
K2CO3 + H2SO4 →K2SO4 +CO2+H2O
Gọi x,y lần lượt là số mol cua K2CO3 va Na2CO3
138x +106y = 5.94
174x + 142y = 7.74
→x= 0.02 y= 0.03
mK2CO3 = 0.02 * 138 =2.76 g
mNa2CO3
= 0.03*106=3.18 g