Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 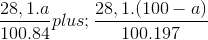 = 0,2
= 0,2
=> a = 29,89.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

m chất rắn giảm =m oxi mất đi => n [O]=0,32/16=0,02 (mol)
n CO,H2= n [O]=0,02 (mol)
=> V =0,02.22,4=0,448 lít

VO2(pư)=1/5Vkk=8.4(l).theo bài ra ta có nCO2+N2=44.8/22.4=2(1)lại có dB/H2=15=>nCO2/nN2=1/7(2).từ (1)và(2)=>nCO2=0.25(mol)và nN2=1.75(mol).
áp dụng ĐLBTKL ta có m=mCO2+mH2O+mN2-mO2(pư)=57(gam).ta lại có mC+mH+mN=nCO2.12+2.nH2O+28.nN2=53(gam) <57(gam)=>trong A có nguyên tố oxi mO=57-53=4(gam).gọi CTĐGN của A là CxHyOzNt ta có:x:y:z:t=nCO2:2nH2O:nO:2nN2=1:4:1:14=>CTĐGN của A:CH4ON14.lại có 12n+4n+16n+196n=600(tớ nghĩ phải là 600 chứ A chứa nhiều nguyên tố lắm)=>n=3=>CTHH của A:C3H12O3N42.

TH1: Cả 2 muối \(NaX\) và \(NaY\) đều pứ vs \(\text{AgNO3}\)
\(NaZ\) + \(AgNO_3\) \(\rightarrow\) \(NaNO_3\) + \(AgZ\)
TH2: 2 muối của X và Y lần lượt là \(NaF\) và \(NaCl\)
Mol \(AgCl\) =8,61/143,5 = 0,06mol
0,06<= 0,06
m\(NaCl\) = 0,06.58,5=3,51g
%m\(NaF\) = 2,52/6,03 .100% = 41,79%
Do AgF tan, khác các muối còn lại nên chia thành 2 trường hợp:
TH1: Hai muối ban đầu là NaF và NaCl —> nNaCl = nAgCl = 0,06 —> %NaF = 41,79%
TH2: Cả 2 muối đều tạo kết tủa:
m tăng = n muối (108 – 23) = 8,61 – 6,03 —> n muối = 0,03 —> M = 198,6 —> Halogen = M – 23 = 175,6: Vô nghiệm

Mol \(Fe\) = 0,11 mol
Mol hh khí= 0,1 mol
BT klg\(\Rightarrow\)m hh khí=12,09-6,16=5,93g
Gọi mol \(Cl_2\) và mol \(O_2\) lần lượt là x và y
\(\Rightarrow\) x+y=0,1 và 71x+32y=5,93
\(\Rightarrow\)x=0,07 và y=0,03
Mol \(Cl-\) trong muối= 0,07.2=0,14 mol = mol \(AgCl\)
\(Fe\) có thể lên \(Fe+2\) và \(Fe+3\) nên
\(Fe\Rightarrow Fe^{+2}+2e\)
a mol. \(\Rightarrow\)2a mol
\(Fe\Rightarrow Fe^{+3}+3e\)
b mol \(\Rightarrow\)3b mol
\(Cl_2+2e\Rightarrow2Cl-\)
0,07 \(\Rightarrow\)0,14 mol
\(O_2+4e\Rightarrow2O_2-\)
0,03\(\Rightarrow\)0,12 mol
Mol e nhường= nhận\(\Rightarrow\)2a+3b=0,26 mol và tổng mol \(Fe\)là a+b=0,11 mol\(\Rightarrow\)a=0,07 và b=0,04
\(Fe^{2+}+Ag^+\Rightarrow Fe^{3+}+Ag\)
0,07 mol \(\Rightarrow\)0,07 mol
Số gam kết tủa = 0,07.108+0,14.143,5=27,65\(\Rightarrow\)chọn A
Đáp án b nhé :44,87...lưu ý khi tính ra số mol fe2+ = 0,07, mol fe3+=0,04 thì =>>> mol Cl- = 0,07x2 + 0,04x3= 0,26 mol.....==>> mol AgCl=0,26.......Để ý hòa tan bằng dd Hcl vừa đủ thì oxit phải chuyển thành hết muối clorua....ko đẻ ý điều này rất dễ nhầm đáp án là A...lừa đó ^^